A | B | C | D |
天然气燃气炉 |
太阳能电池 |
水电站 |
电解精炼铜 |
化学能→热能 | 太阳能→电能 | 化学能→电能 | 电能→化学能 |
选项 | 实验操作及现象 | 结论 |
A | 向AgCl固体滴加饱和Na2CrO4溶液,有砖红色沉淀生成 | Ksp(Ag2CrO4)<Ksp(AgCl) |
B | 向含酚酞的Na2CO3溶液中加入BaCl2固体,溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 用pH试纸分别测定同等条件下NaClO溶液和CH3COONa 溶液的pH,前者pH值较大 | Ka(CH3COOH)> Ka(HClO) |
D | 向一定浓度的Na2S2O3溶液中滴入稀盐酸,溶液变浑浊 | 盐酸将Na2S2O3还原为S单质 |
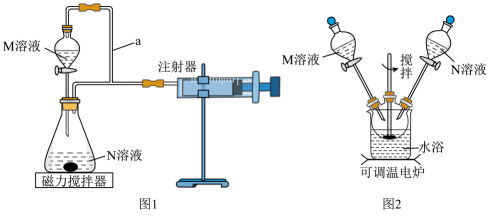
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为。
②盛装M溶液的仪器名称为,a的作用是。
③该实验探究的是对化学反应速率的影响。
④在反应停止前,相同时间内注射器中所得CO2的体积较多的是(填“实验Ⅰ”或“实验Ⅱ”)。
实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
序号 | M溶液 | N溶液 | 水浴温度 |
A | 含0.01mol碘的四氯化碳溶液20mL | 20mL0.4 mol·L-1的K2C2O4溶液 | 40℃ |
B | 含0.01mol碘的四氯化碳溶液20mL | 20mL0.8 mol·L-1 | 40℃ |
C | 含0.01mol碘的四氯化碳溶液20mL | 20mL0.8 mol·L-1的K2C2O4溶液 | 50℃ |
①该实验探究的是对化学反应速率的影响。
②该组同学始终没有观察到实验A的溶液褪色,其原因是。
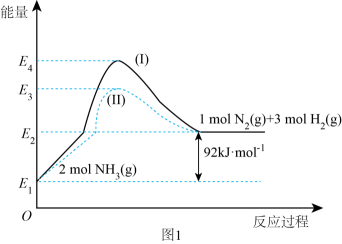
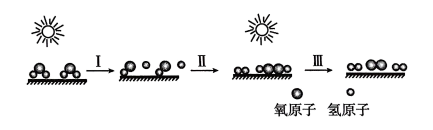
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为。
②过程(Ⅰ)和过程(Ⅱ)的反应热(填“相同”或“不同”)。
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8。
a.该温度下的平衡常数为。(只列计算式)
b.N2的平衡转化率为。
反应Ⅰ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=(用含a、c的代数式表示),K3=(用K1和K2表示)。
a.N2的浓度不再改变
b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化
d.混合气体的密度保持不变
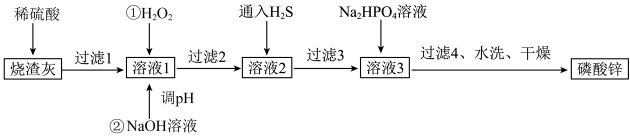
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |