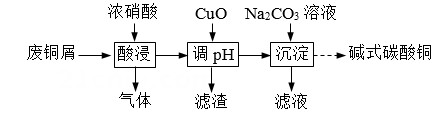
已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 |
开始沉淀pH | 1.9 | 6.5 | 4.2 | 3.4 |
沉淀完全pH | 3.2 | 9.7 | 6.7 | 4.0 |
①提高Cu元素浸出速率的方法还有。
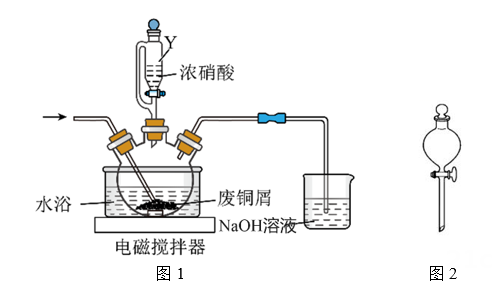
②与使用图2所示漏斗相比,使用漏斗Y的优点是。
①滴定法涉及的部分反应:
2Cu2+ + 4I- =2CuI↓+ I2、I2 + 2Na2S2O3 = 2NaI + Na2S4O6。
请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。;根据数据计算Cu元素含量(须使用的试剂:KI溶液、0.1000 mol/L Na2S2O3溶液、淀粉溶液)。
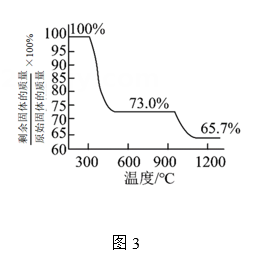
②测得碱式碳酸铜的热重分析结果如图3所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知(保留3位有效数字)。