 B . Na2O2既含离子键又含共价键
C . H2O2的电子式为
B . Na2O2既含离子键又含共价键
C . H2O2的电子式为 
|
|
|
|
A.制取NH3 | B.干燥NH3 | C.验证氨气的还原性 | D.吸收尾气 |
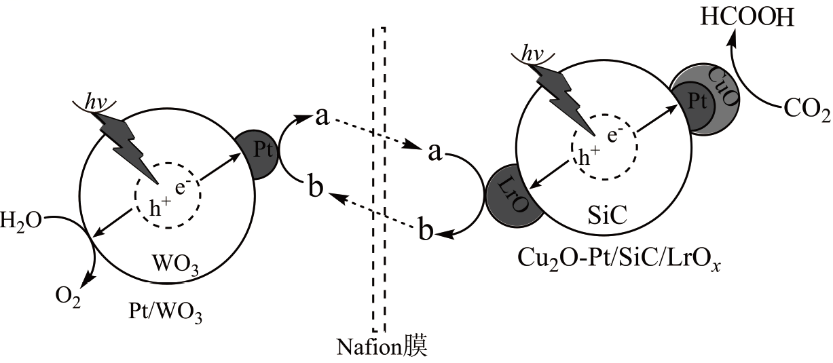
周期表中ⅢA族元素(5B、13Al、31Ga、49In等)的单质及其化合物应用广泛。BF3极易水解,生成HBF4(HBF4在水中完全电离为H+和BF4-)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铟(In)主要用于生产液晶显示器和平板屏幕。
选项 | 实验探究方案 | 探究目的 |
A | 向Fe(NO3)2和KSCN的混合溶液中滴入稀硫酸 | 氧化性:Fe3+>H+ |
B | SO2通入酸性KMnO4溶液中 | SO2具有漂白性 |
C | 向试管中加入2mL5% H2O2和1mL2%CuSO4溶液,观察气泡产生情况 | Cu2+可促进H2O2分解 |
D | 向新制氯水中加入NaHCO3固体 | 氯水呈酸性 |
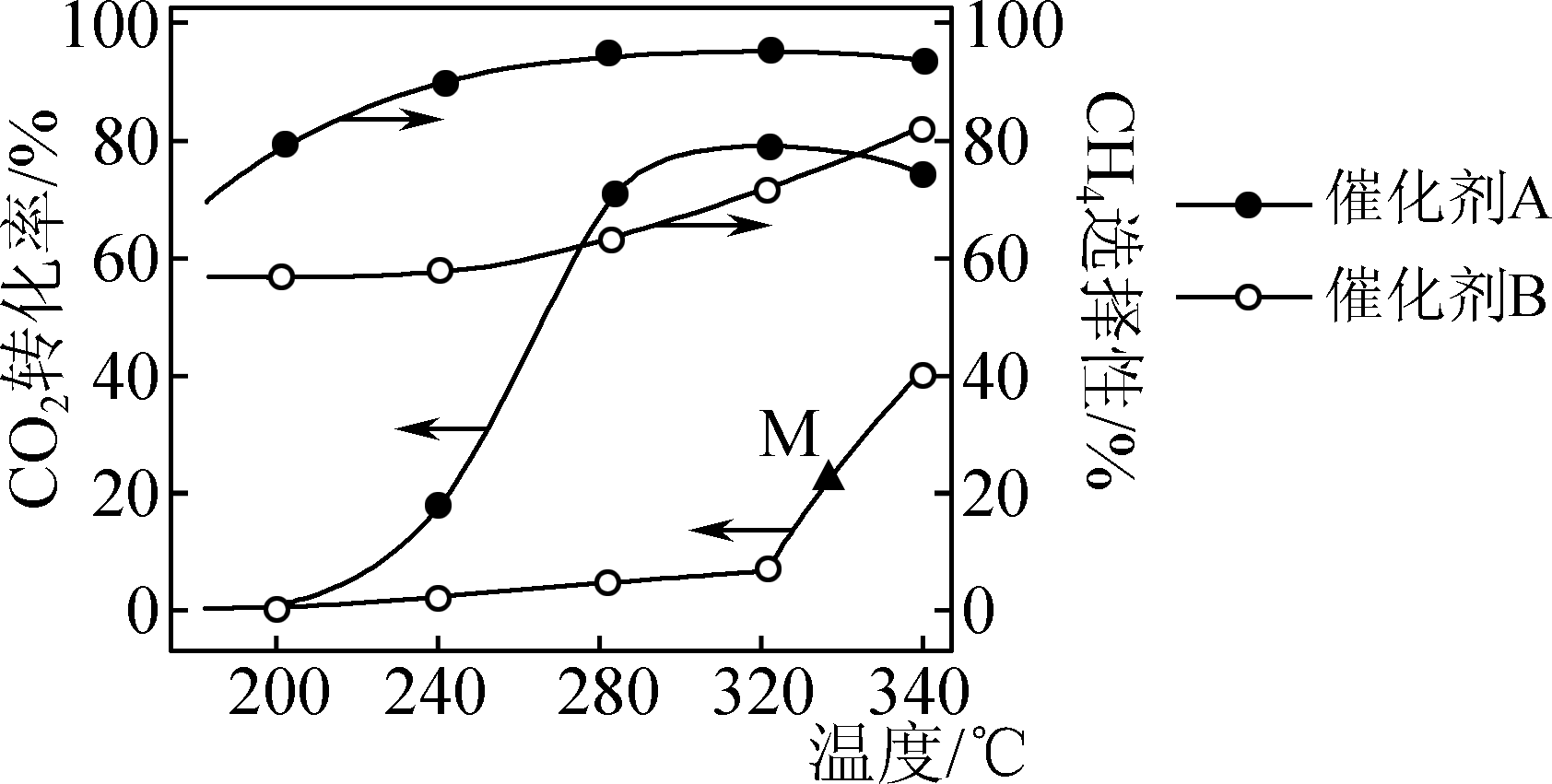
已知:Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol-l
Ⅱ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1
在两种不同催化剂作用下反应相同时间,CO2转化率和生成CH4选择性随温度变化关
系如图所示(CH4选择性=×100%)。
下列说法不正确的是( )
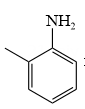
①含有苯环的α-氨基酸;
②1H-NMR谱表明分子中共有6种不同化学环境的氢原子。
 和H2C=CH2为原料合成
和H2C=CH2为原料合成 的合成线路(有机溶剂和无机试剂任选)。
的合成线路(有机溶剂和无机试剂任选)。
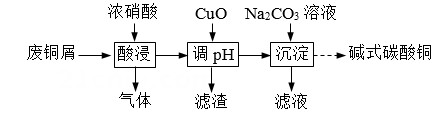
已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 |
开始沉淀pH | 1.9 | 6.5 | 4.2 | 3.4 |
沉淀完全pH | 3.2 | 9.7 | 6.7 | 4.0 |
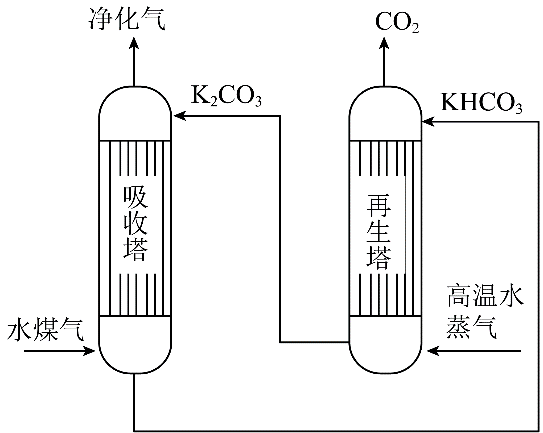
①提高Cu元素浸出速率的方法还有。
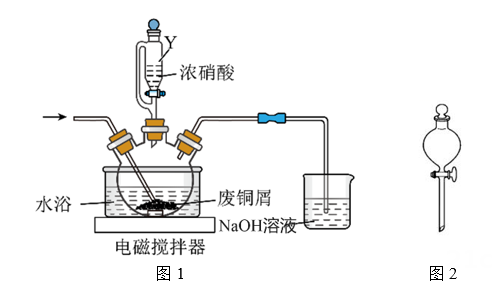
②与使用图2所示漏斗相比,使用漏斗Y的优点是。
①滴定法涉及的部分反应:
2Cu2+ + 4I- =2CuI↓+ I2、I2 + 2Na2S2O3 = 2NaI + Na2S4O6。
请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。;根据数据计算Cu元素含量(须使用的试剂:KI溶液、0.1000 mol/L Na2S2O3溶液、淀粉溶液)。
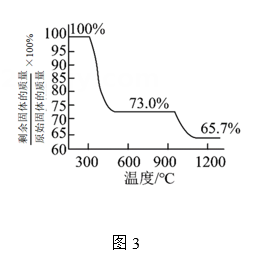
②测得碱式碳酸铜的热重分析结果如图3所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知(保留3位有效数字)。
反应1:CO2(g) + 3H2(g)CH3OH(g) + H2O(g) ΔH1= - 49.5 kJ/mol
反应2:CO2(g) + H2(g)CO(g) + H2O(g) ΔH2= + 41.2 kJ/mol
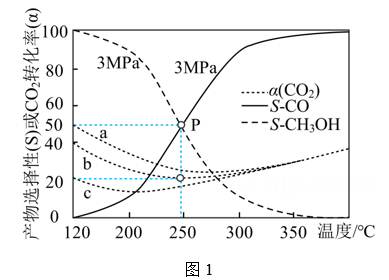
①随着温度升高,a、b、c三条曲线接近重合的原因是。
②250℃时,反应2的平衡常数K=。
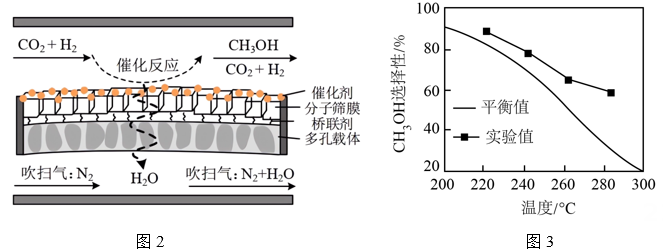
①随温度升高,平衡时CH3OH选择性降低的原因是。
②温度相同时,CH3OH选择性的实验值高于平衡值,其原因可能是。
③分子筛膜反应器可提高CO2转化率的原因是。