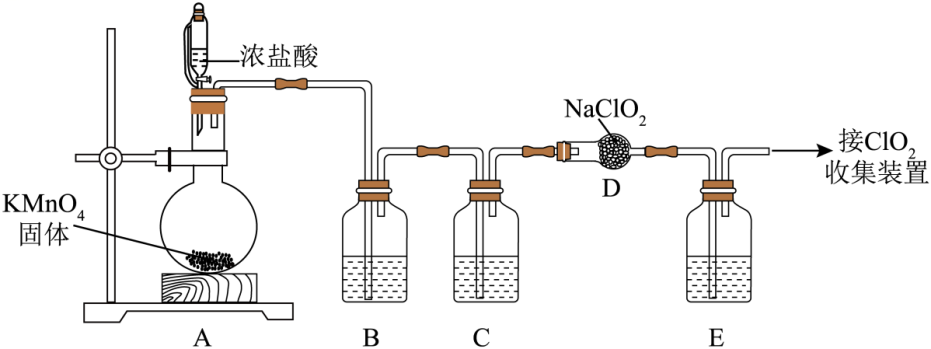
Ⅰ.利用NaClO2与纯净的Cl2反应可制得ClO2和NaCl,实验装置如图所示(夹持装置略)。
2KClO3+H2C2O4 = K2CO3+CO2↑+2ClO2↑+H2O。
该方法制备ClO2的优点是。

已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42- , 写出该法制备ClO2
气体的离子方程式:,由图可知,反应时采取的适宜措施是。
4H++ ClO2 + 5Fe2+= Cl-+ 5Fe3++ 2H2O;
H++ Fe2++ Cr2O―― Cr3++ Fe3++ H2O (未配平),试计算ClO2的产率