 B .
B .  的命名:2-甲基丁烷
C . 乙烯的结构简式为CH2CH2
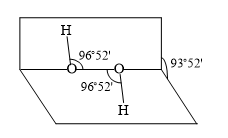
D . NH3的VSEPR模型为
的命名:2-甲基丁烷
C . 乙烯的结构简式为CH2CH2
D . NH3的VSEPR模型为 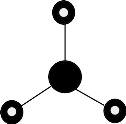
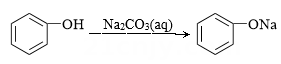 B .
B . 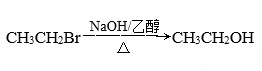 C .
C . 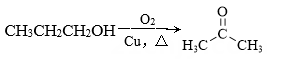 D .
D . 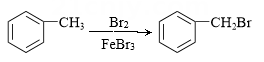
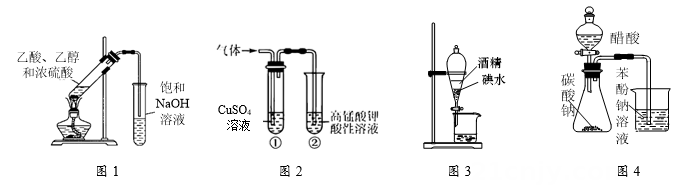
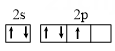 D .
D . 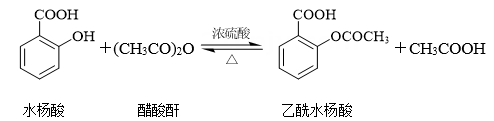
用乙二醇将乙酰水杨酸与聚甲基丙烯酸(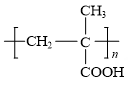 )连接起来,可得到缓释阿司匹林,
)连接起来,可得到缓释阿司匹林,
其结构如下: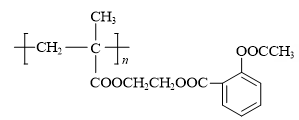

| 探究方案 | 探究目的 |
A | 将卤代烃与NaOH溶液加热,冷却后,向体系中加稀硝酸调节至酸性,滴加硝酸银溶液,观察沉淀颜色 | 确定卤代烃中卤素原子种类 |
B | 取4 mL乙醇,加入12 mL浓硫酸及少量沸石,迅速升温至170℃,将产生的气体通入酸性高锰酸钾溶液,观察溶液颜色变化 | 验证乙醇发生消去反应 |
C | 向1 mL 0.1 mol·L-1 NaOH溶液中加入2 mL 0.1 mol·L-1 CuSO4溶液,振荡后滴加0.5 mL有机物X,加热,观察是否产生砖红色沉淀 | 确定X中是否含有醛基结构 |
D | 向Fe(NO3)2溶液中滴加硫酸酸化的H2O2溶液,观察溶液颜色变化 | 证明氧化性H2O2 > Fe3+ |
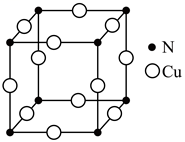
该物质的化学式为。
②CuBr2的水溶液呈蓝色,蓝色物质为水合铜离子,可表示为 [Cu(H2O)4]2+ , 1 mol [Cu(H2O)4]2+含有σ键的数目为。[Cu(H2O)4]2+的结构式可表示为。
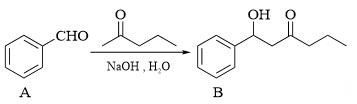
① 的酮羰基相邻碳原子上的C-H键极性强,易断裂,原因是。
的酮羰基相邻碳原子上的C-H键极性强,易断裂,原因是。
②该条件下还可能生成一种副产物,与B互为同分异构体。该副产物的结构简式是。
C2H5OH(g)+3O2(g) = 2CO2(g)+3H2O(g) △H2=-Q2 kJ·mol-1
H2O(g) = H2O(l) △H3=-Q3 kJ·mol-1
则C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) △H=kJ·mol-1(用含有Q1、Q2、Q3的式子表示),若将23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为kJ。
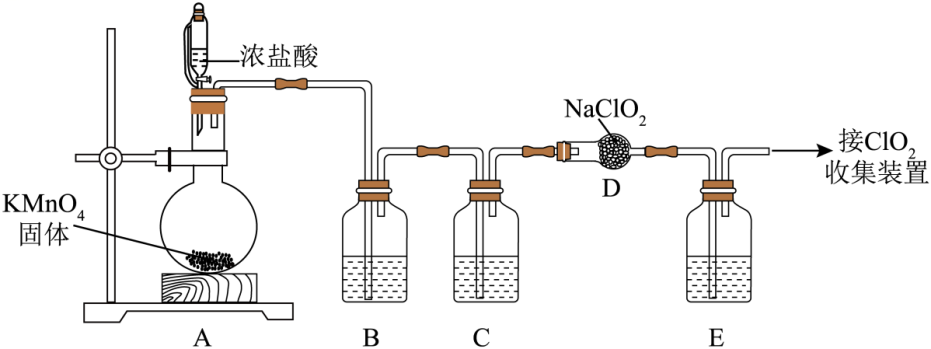
Ⅰ.利用NaClO2与纯净的Cl2反应可制得ClO2和NaCl,实验装置如图所示(夹持装置略)。
2KClO3+H2C2O4 = K2CO3+CO2↑+2ClO2↑+H2O。
该方法制备ClO2的优点是。

已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42- , 写出该法制备ClO2
气体的离子方程式:,由图可知,反应时采取的适宜措施是。
4H++ ClO2 + 5Fe2+= Cl-+ 5Fe3++ 2H2O;
H++ Fe2++ Cr2O―― Cr3++ Fe3++ H2O (未配平),试计算ClO2的产率
碱性条件下水解后酸化生成两种产物。一种产物含有苯环,其核磁共振氢谱只有2组峰;另一种产物能与银氨溶液反应,被氧化为碳酸后分解生成二氧化碳和水。
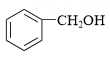 为原料制备
为原料制备 的合成路线流程图(须用Ph3P,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(须用Ph3P,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

已知:调节溶液的pH可以使水溶液中的金属离子形成氢氧化物沉淀,下表为相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | Al3+ | Fe2+ | Fe3+ |
沉淀开始pH | 3.1 | 5.9 | 1.2 |
沉淀完全 pH | 5.1 | 6.9 | 3.2 |
途径一:![]()
途径二:![]()
①请选择较合理的途径并说明理由。
②“加铁粉”时发生主要反应的离子方程式。

Na2CO3溶液的浓度大于 4 mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是。