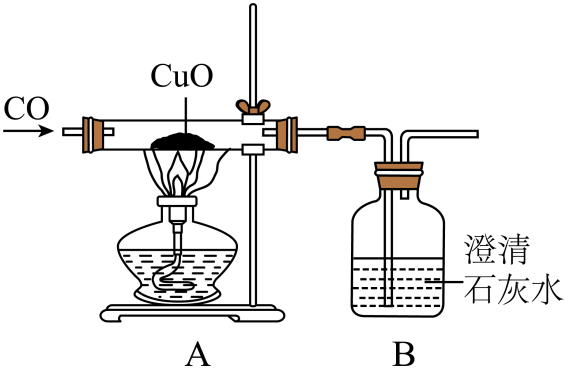
【查阅资料】
Ⅰ.氧化铜被还原的过程中可能会生成氧化亚铜(Cu2O),Cu2O也能被还原成铜;
Ⅱ.Cu和Cu2O均为不溶于水的红色固体
Ⅲ.Cu与稀硫酸不反应。
Ⅳ.Cu2O能和稀硫酸反应,反应后溶液为蓝色,反应的化学方程式为
【提出问题】反应后生成的红色固体成分是什么?
【作出猜想】
猜想一:红色固体只有Cu;
猜想二:红色固体只有Cu2O
猜想三:红色固体含有。
设计如下实验方案:
实验操作 | 现象 | 结论 |
取少量红色固体于试管中,加入过量的稀硫酸 | 。 | 红色固体含有Cu2O |
甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是。
①小组同学通过老师的指导进行了后续实验,证明了猜想三成立。
②该实验在进行操作时,一定要先通入一氧化碳一段时间后再点燃酒精灯,理由是。
为确定CO和CuO反应的最佳温度,小组同学利用原位X射线衍射仪来测定不同温度下反应后的固体物质成分,实验结果如图所示,据图回答下列问题。
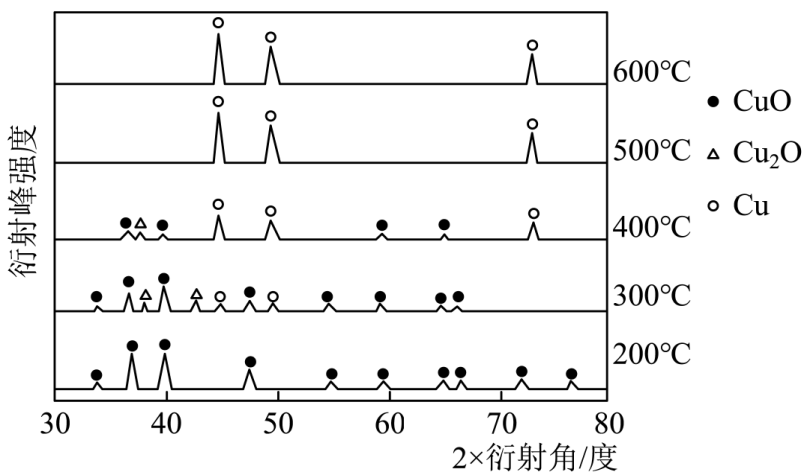
①用CO还原CuO制取纯净的Cu,反应温度至少要控制在℃以上。
②300℃时,反应后的固体中含有:。