CuSO4+4NaCl(过量)=Na2[CuCl4]+Na2SO4
2Na2[CuCl4]+SO2+2H2O=2NaH[CuCl3]+H2SO4+2NaCl
。
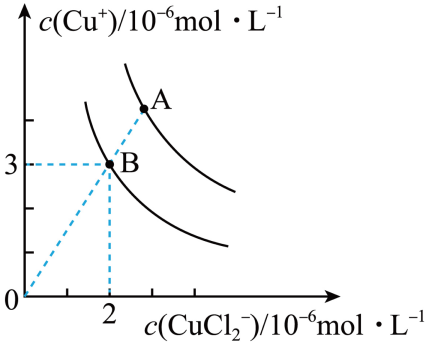
①上述反应在B点的平衡常数K=。
②使图中的A点变为B点的措施可以是。
①除Cl-的方法是向含Cl-的溶液同时加入Cu和CuSO4 , 该反应的离子方程式为。
②若用Zn替换Cu可加快除Cl-速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是。
| 1 | 2 | 3 |
消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
若未用标准溶液润洗滴定管,则会使测定结果(填“偏大”、“偏小”或“不变”)。