
![]()
下列说法错误的是( )
反应ⅰ:H2O2+2I-+2H+=I2+2H2O
反应ⅱ:C6H8O6(维生素C)+I2=C6H6O6+2I-+2H+
下列说法不正确的是( )

|
| ||||
|
| A | B |
|
|
C | D | E | |||

选项 | 实验操作 | 现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和NaClO的pH | Na2CO3>NaClO | 酸性:H2CO3<HClO |
B | 向浓度均为0.10mol/L的KCl和KI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3+3KSCN⇌Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 | 溶液血红色变浅 | 增大生成物浓度,平衡逆向移动 |
D | 用pH试纸测量同浓度的CH3COOH、HClO的pH,比较溶液pH大小 | HClO的pH比CH3COOH大 | 说明CH3COOH酸性比HClO强 |

下列说法正确的是( )

a.![]() b.
b.![]()
c.![]() d.
d.![]()
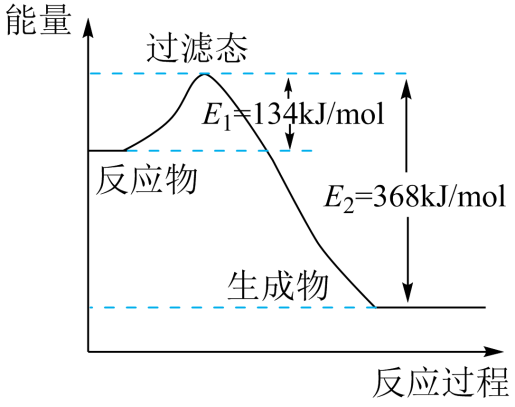
①若在反应体系中加入催化剂,反应速率增大,E1(填“增大”“减小”或“不变”)。
②写出NO2和CO反应的热化学方程式。
①
②
③
写出乙烷(C2H6)标准摩尔生成焓的焓变∆H=(用含∆H1、∆H2、∆H3的式子表示)。
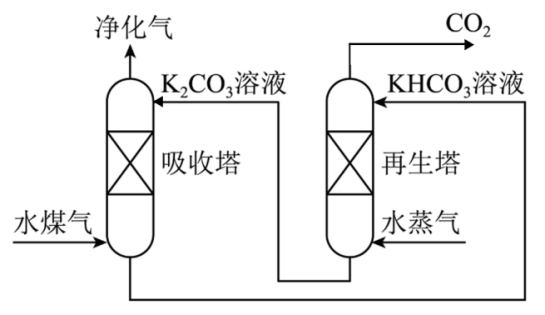
①在某温度下,吸收塔中的K2CO3溶液吸收一定量的CO2后,溶液的pH等于10,则此时溶液中c(CO32-):c(HCO3-)=(该温度下H2CO3的Ka1=4.6×10-7 , Ka2=5.0×10-11)。
②再生塔中产生CO2的化学方程式为
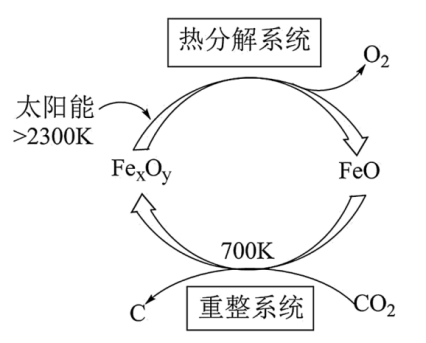
已知“重整系统”发生的反应中 , 则“重整系统”发生反应的化学方程式为。
 ①该反应在自发进行(填“低温”或“高温”)。
①该反应在自发进行(填“低温”或“高温”)。
②b代表的物质是。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举2项)。
④温度下CO2的平衡转化率为。
CuSO4+4NaCl(过量)=Na2[CuCl4]+Na2SO4
2Na2[CuCl4]+SO2+2H2O=2NaH[CuCl3]+H2SO4+2NaCl
。
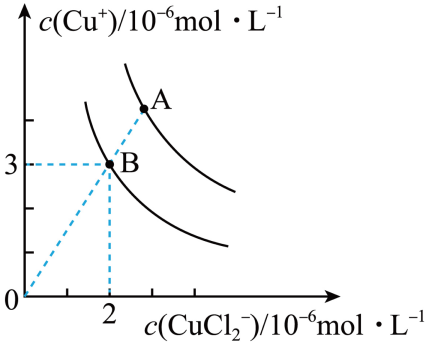
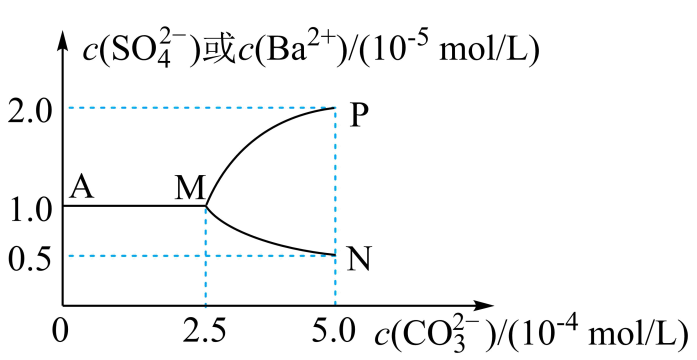
①上述反应在B点的平衡常数K=。
②使图中的A点变为B点的措施可以是。
①除Cl-的方法是向含Cl-的溶液同时加入Cu和CuSO4 , 该反应的离子方程式为。
②若用Zn替换Cu可加快除Cl-速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是。
| 1 | 2 | 3 |
消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
若未用标准溶液润洗滴定管,则会使测定结果(填“偏大”、“偏小”或“不变”)。
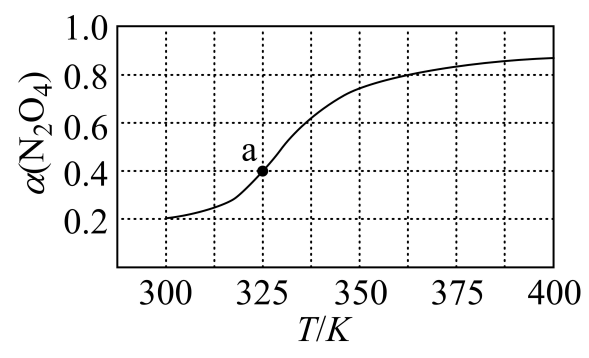 ①由图推测该反应的∆H0(填“>”或“<”),理由为。
①由图推测该反应的∆H0(填“>”或“<”),理由为。
②a点对应的温度下,已知N2O4的起始压强为90kPa,平衡后总压强为kPa,该温度下反应的平衡常数Kp=kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①Cl-在阳极转化为Cl2;②Cl2在碱性溶液中歧化为ClO-;③ClO-将二甲胺氧化为N2 , CO32-和H2O。
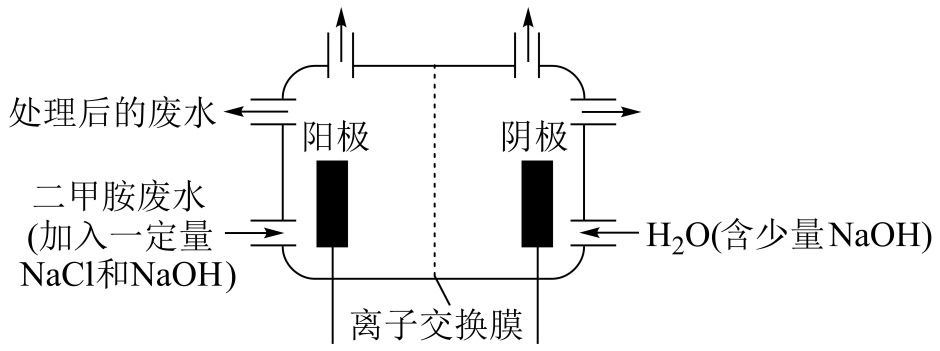
①写出电解池中阴极发生反应的方程式。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是。
③当阴极区收集到6.72L (标况下)H2时,阳极区收集到N2的体积(标况下)是L。