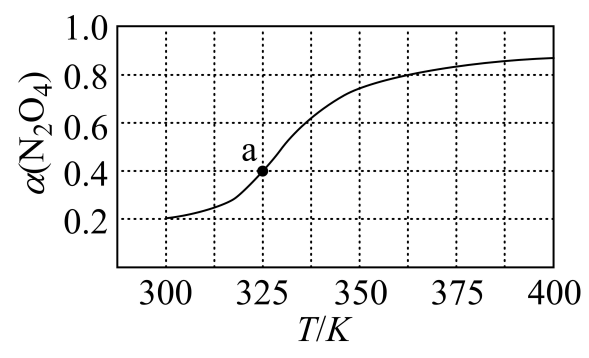
 ①由图推测该反应的∆H0(填“>”或“<”),理由为。
①由图推测该反应的∆H0(填“>”或“<”),理由为。
②a点对应的温度下,已知N2O4的起始压强为90kPa,平衡后总压强为kPa,该温度下反应的平衡常数Kp=kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①Cl-在阳极转化为Cl2;②Cl2在碱性溶液中歧化为ClO-;③ClO-将二甲胺氧化为N2 , CO32-和H2O。
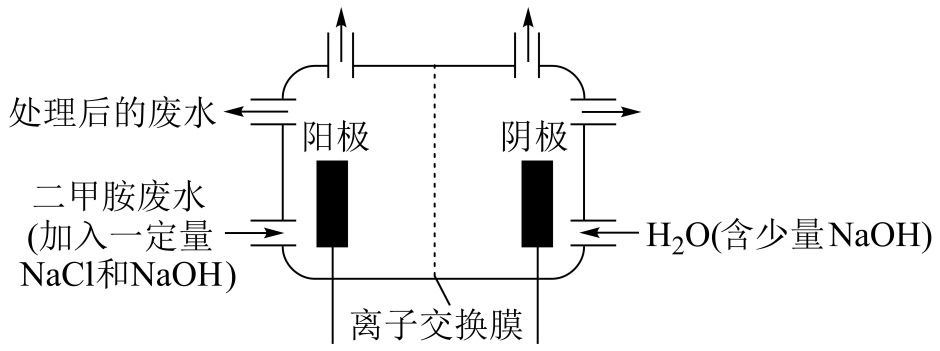
①写出电解池中阴极发生反应的方程式。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是。
③当阴极区收集到6.72L (标况下)H2时,阳极区收集到N2的体积(标况下)是L。