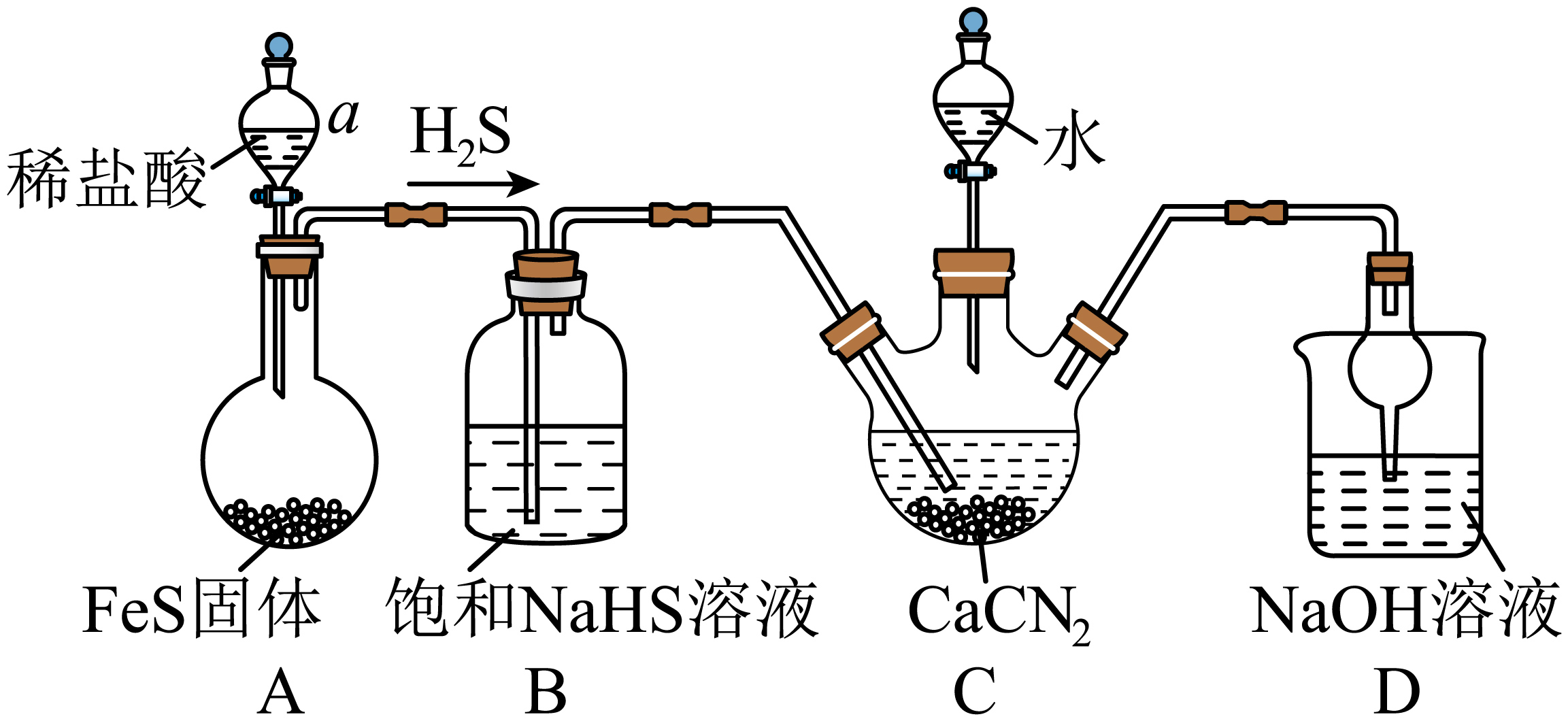
已知合成硫脲的反应原理为:
回答下列问题:
步骤1:称取20.00g产品溶于水,配制成100mL溶液备用
步骤2:向一锥形瓶中加入0.03mol碘单质和足量NaOH溶液,发生反应:
步骤3:向锥形瓶中加入10.00mL步骤1配制的溶液,发生反应:
步骤4:待步骤3反应充分后加稀硫酸,发生反应:
步骤5:以淀粉溶液作为指示剂,用1.00的
, 标准液滴定步骤4得到的溶液,发生反应:
, 平行滴定三次,消耗
标准液的平均体积为20.00mL
①判断达到滴定终点的实验现象是。
②产品中硫脲的含量为。
③下列操作会导致测得的硫脲含量偏高的是(填字母)。
A.配制溶液时,所用容量瓶未干燥
B.“步骤4”加入稀硫酸的量不足
C.盛装标准液的试管未润洗
D.滴定开始时俯视读数,达到滴定终点时仰视读数