
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是,表明SO2吸收效率低的实验现象是B中溶液。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。(任写一条)
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, 。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,。 | 与白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
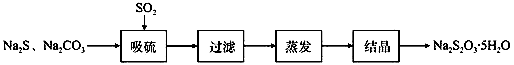
第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为v mL。则c(Na2S2O3)=mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-。甲同学盛装Na2S2O3溶液之前未润洗,这样测得的Na2S2O3的浓度可能(填“无影响”、“偏低”或“偏高”);乙同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能(填“无影响”、“ 偏低”或“偏高”)。