①含有HCO3-的溶液中:SO42-、Na+、NO3-、CO32-
②水电离的H+浓度为1×10-13moI·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+、S2O32-
③加入Al能放出H2的溶液中:Mg2+、NO3-、Cl-、K+、SO42-
④在AlCl3溶液中:NH4+、NO3-、Cl-、SO42-、CO32-
下列说法正确的是( )
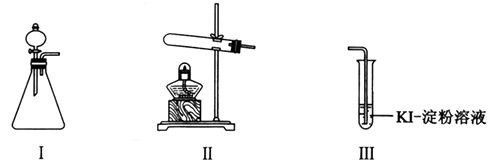
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
操作 | 现象 | |
甲 | 向I的锥形瓶中加入,.向I的中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |

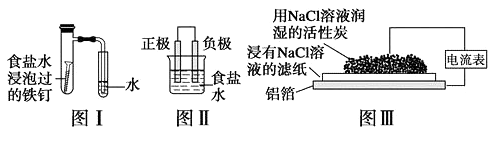
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是,表明SO2吸收效率低的实验现象是B中溶液。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。(任写一条)
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, 。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,。 | 与白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
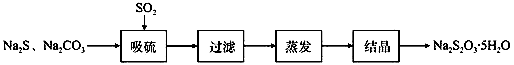
第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为v mL。则c(Na2S2O3)=mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-。甲同学盛装Na2S2O3溶液之前未润洗,这样测得的Na2S2O3的浓度可能(填“无影响”、“偏低”或“偏高”);乙同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能(填“无影响”、“ 偏低”或“偏高”)。
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:。

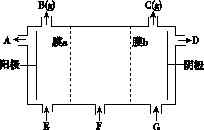
①写出燃料电池负极的电极反应式。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为L。


完成下列填空:
a.减压
b.增加NH3的浓度
c.升温
d.及时移走产物
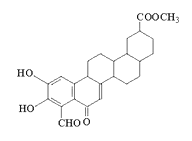
① 能发生银镜反应;② 能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应。