反应I:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式。
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
I | V1 | 0.1 | 0 | 0 |
II | 1.0 | 0.1 | 0 | 0 |
III | V2 | 0.1 | 0 | 0 |
IV | 1.0 | 0.06 | 0.06 | 0.04 |
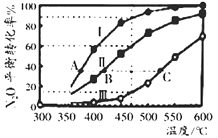
①该反应的△H0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是;
③容器IV在470℃进行反应时,起始速率:v(N2O)正v (N2O)逆(填“>”、“=”、“<”)。

①该催化剂在低温时选择反应(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是。