选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三角架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入混合液液面以下 |
D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
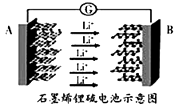


实验步骤:
步骤I如图连接装置,检查装置气密性,装入药品;
步骤II旋开滴液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤III当硬质玻璃管中固体质量不再改变时,停止加热,继续向烧瓶中滴水一段时间
步骤IV实验结束后,将D中所得溶液加水配制成250mL溶液;
……
请回答:
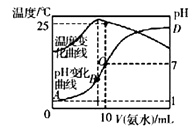
①所选试剂应装在(填“酸式”或“碱式”) 滴定管中。
②所利用的反应原理为(用离子方程式表示)。
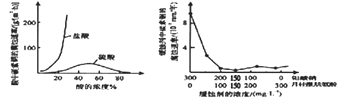
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1 , 则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓度为(计算结果保留3位有效数字)。
I.能与FeCl3溶液发生显色反应
II.能发生银镜反应
III.核磁共振氢谱有4组峰且峰面积之比为6:2:1:1
反应I:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式。
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
I | V1 | 0.1 | 0 | 0 |
II | 1.0 | 0.1 | 0 | 0 |
III | V2 | 0.1 | 0 | 0 |
IV | 1.0 | 0.06 | 0.06 | 0.04 |
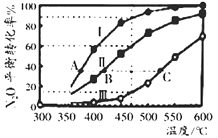
①该反应的△H0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是;
③容器IV在470℃进行反应时,起始速率:v(N2O)正v (N2O)逆(填“>”、“=”、“<”)。

①该催化剂在低温时选择反应(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是。
