)的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。I. H2Y2-与Fe2+形成的络合物FeY2- 可用于吸收烟气中的NO。其吸收原理:
FeY2- (aq)+ NO(g) FeY2-(NO) (aq) △H<0

若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为。
H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K 为平衡常数) |
Cu2++ H2Y2- | 18.8 |
Fe3++ H2Y2- | 25.1 |
Ca2++ H2Y2- | 10.7 |
①表中最不稳定的金属络合物是(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A 可解离出Cu2+ , 则盐A中阳离子为(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
①酸性条件下,-OH 可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为。
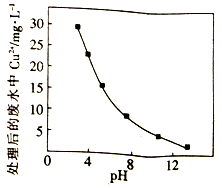
②Na2FeO4 在酸性条件下不稳定。用Na2FeO4 处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,废水处理效果越好,这是因为。