2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH= kJ·mol−1。
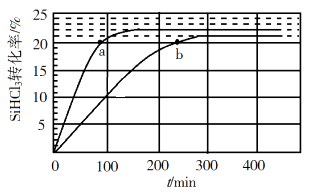
①343 K时反应的平衡转化率α=%。平衡常数K343 K=(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是;要缩短反应达到平衡的时间,可采取的措施有、。
③比较a、b处反应速率大小:vavb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆= −
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
=(保留1位小数)。