2AlH3(g)=2Al(s)+3H2(g) △H1 H2(g)+ O2(g)=H2O(g) △H2 Al(s)= Al(g) △H3 Al(g) +
O2(g)=
Al2O3(s) △H4

下列分析正确的是( )
②C2H6(g)+ =2CO2(g)+3H2O(l) DH 2 =-1559.8 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) DH 3=-1411.0 kJ·mol-1
下列叙述正确的是( )

|
选项 |
实验操作 |
实验现象 |
实验结论 |
|
A |
向盛有1 mL浓硫酸的试管中加入5 mL 0 .1 mol/L的K2 Cr2 O7溶液 |
溶液橙 色变深 |
增大生成物浓度,平衡Cr2 O |
|
B |
向Mg(OH)2悬浊液中加入少量醋酸铵晶体 |
沉淀溶解,溶液变澄清 |
说明反应Mg2++2NH3·H2O |
|
C |
相同温度下,同时向①4mL0.1 mol/L. KMnO4),酸性溶液和②4 mL 0.2 mol/LKMnO4 , 酸性溶液中,分别加入4mL 1 mol/L. H2 C2 O4溶液 |
①中溶液先褪色 |
该实验条件下,KMnO4浓度越小,反应速率越快 |
|
D |
向煤炉中灼热的煤炭上洒少量水 |
产生淡蓝色火焰煤炭燃烧更旺 |
加少量水后,可使煤炭燃烧放出更多的热量 |


2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
反应I:CH4(g) + CO2(g) 2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g) CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是( )
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH= kJ·mol−1。
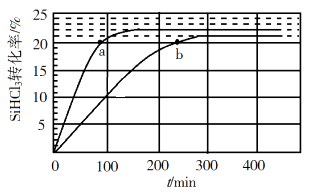
①343 K时反应的平衡转化率α=%。平衡常数K343 K=(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是;要缩短反应达到平衡的时间,可采取的措施有、。
③比较a、b处反应速率大小:vavb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆= −
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
=(保留1位小数)。

其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
P/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3kJ·mol-1
则反应N2O5(g)=2NO2(g)+ O2(g)的△H= kJ·mol-1
②研究表明,N2O5(g)分解的反应速率v=2×10-3× (KPa·min-1),t=62min时,测得体系中
=2.9kPa,则此时的
= kPa,V= kPa,min-1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强pX(35℃)63.1kPa(填“大于”“等于”或“小于”),原因是。
④25℃时N2O4(g) ⇋2NO2(g)反应的平衡常数Kp= kPa (Kp为以分压表示的平衡常数,计算结果保留1位小数)。
第一步N2O5⇋NO3+NO2 快速平衡
第二步NO2+NO3⇀NO+NO2+O2 慢反应
第三步NO+NO3⇀2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
III.CO(g)+2H2(g)CH3OH(g),ΔH3=-90.6kJ·mol-1
回答下列问题:
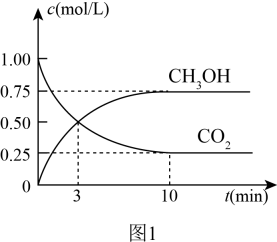
反应i:Cu/ZnO(s)+H2(g)=Cu/Zn(s)+H2O(g) ΔH>0
反应ii: ΔH<0
反应ii的化学反应方程式为。

①图1中与实线相比,虚线改变的条件可能是。
②该反应在0~4min内(实线)H2O的平均反应速率为(保留2位有效数字)。
③该条件下(实线)的Kp为MPa-2。
④Cu2O的立方晶胞结构如图2所示。白球代表的是(填“Cu+”或“O2-”);a、b的坐标参数依次为(0,0,0)、( ,
,
),则d的坐标参数为。

已知Arrhenius经验公式为Rlnk=-Ea/T+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率进行了实验探究,获得如图3曲线。从图中信息获知催化剂的催化效率mn(填“>”“=”或“<”),其理由是。


②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=-75.6kJ•mol-1
则③CO(g)+2H2(g)CH3OH(g)△H=。

已知:I.
II.
①则反应III: , 该反应能自发进行的条件是在(填“低温”、“高温”或“任意温度”)下。
②向某绝热恒容密闭容器内充入一定量的和
, 发生反应III。下列能说明该反应达到平衡状态的是(填标号)。
A.容器内气体的密度不再改变 B.容器内气体的温度不再改变
C. D.容器内气体的平均摩尔质量不再改变
③向容积均为的三个恒容密闭容器中分别通入
和
, 发生上述反应Ⅲ,a、b、c三组实验的反应温度分别记为
。恒温恒容条件下反应各体系压强的变化如图所示。则达到平衡时
由大到小的顺序是;实验b中,
内,
分压的平均变化率为
, 该反应的压强平衡常数
(以分压表示,分压=总压×物质的量分数)。


①2号原子的坐标为。
②原子和
原子之间的最短距离为(不用化到最简)
。
i.Cat[ ]+SO2=Cat[O]+SO
ii.Cat[ ]+SO=Cat[O]+S
iii.……
①写出第iii步反应方程式:。
②在500℃条件下(硫的沸点445℃),将0.05mol混合气体(CO体积分数0.1%,SO2体积分数为0.05%,其余为N2)通入1L刚性容器中,在催化剂作用下发生反应,100min时测得CO体积分数0.01%。
i.100min时SO2去除率为。
ii.0~100min内CO平均反应速率v(CO)=。
③已知脱硫总反应的△H>0,其他条件相同时,以γ-Al2O3作为催化剂,反应相同的时间,SO2的去除率随反应温度的变化如图所示,当温度高于500℃,SO2去除率降低的原因是。


①克劳斯法脱硫的总反应的热化学方程式为。
②在一定温度、285kPa反应条件下,将n(H2S):n(O2)=2:1混合气进行下列反应:
I.2H2S(g)+3O2(g)2SO2(g)+2H2O(g)
II.2SO2(g)+4H2S(g)3S2(g)+4H2O(g)
测得平衡时混合气体中S2与SO2的分压相等,且H2S平衡转化率为45%,此时p(S2)=;反应I的平衡常数Kp=(列出数字运算表达式即可)。


①X代表(填“温度”或“压强”),(填“>”、“”或“=”)
。
②M点时,和
的浓度相等。则M点对应的反应2的平衡常数
。

I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ•mol-1
II.CO2(g)+H2(g) CO(g)+H2O(g) △H2
回答下列问题:
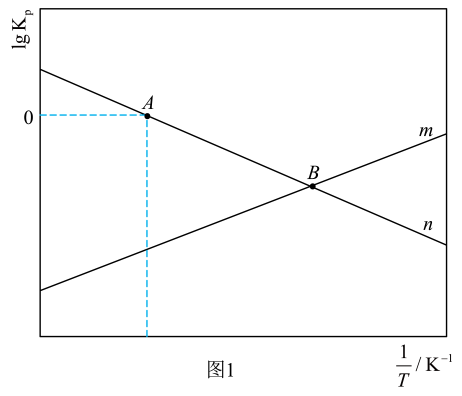
①反应Ⅱ对应图1中(填“m”或“n”);A点对应温度下体系达到平衡时CO2的转化率为80%,反应Ⅰ的Kp=kPa-2(保留两位有效数字)。
②通过调整温度可调控平衡时的值。B点对应温度下,平衡时
=400,则p(H2)= kPa。

①在一定条件下,催化乙烷脱氢转化为乙烯的反应历程如图所示,该历程的各步反应中,生成下列物质速率最慢的是。

A. B.
C.
D.
②用基催化剂研究
催化脱氢,该催化剂对
键和
键的断裂均有高活性,易形成碳单质。一定温度下,
基催化剂在短时间内会失活,其失活的原因是。

①图中曲线c表示的物质为 , 表示
的曲线为(填“a”或“b”),判断依据是。
②当时,平衡时体系压强为P,计算反应Ⅰ的平衡常数
(写出计算过程,结果保留2位有效数字;对于
,
,
)。
①
②
③
④

①反应④中,a点的(填“>”“<”或“=”)。
②对反应体系加压,得到平衡时的转化率
与压强的关系如图乙所示。请解释压强增大至
的过程中
逐渐增大的原因:。
③图甲中,时,平衡后总压为
,
的分压为
的两倍,则反应④以压强表示的平衡常数
(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留两位小数)。

①(填“>”、“<”或“=”);温度为
时,从a到b历时
, 则此时段
。
②同一温度下,图像呈线性变化的理由是;a、b两点体系总压强与
的比值
。

(ⅰ)若时到达c点,则
时的平均反应速率
;
(ⅱ)(写计算表达式);
(ⅲ)c点时,再加入和
, 使两者分压均增大
的转化率(填“增大”、“不变”或“减小”)。

写出与
反应生成
和
的热化学方程式。
①下列操作中,能提高比平衡转化率的是。
a.加入催化剂||| b.降低反应温度
c.移除 d.恒温恒压下通入惰性气体
②某科研小组在一定温度下模拟该反应,向容积为5L的抽空的密闭容器中通入和
, 反应平衡后测得
的转化率为50%,则该反应的平衡常数为。

保持压强为3MPa,温度为260℃,向密闭容器中按投料比投入一定量
和
, 不同反应模式下
的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
实验组 | 反应模式 | 温度/℃ |
|
| |
Ⅰ | 普通催化反应器 | 3 | 260 | 21.9 | 67.3 |
Ⅱ | 分子筛膜催化反应器 | 3 | 260 | 36.1 | 100 |
①双功能的分子筛膜催化反应器模式下,恒温恒容时发生反应 , 不能说明反应达到化学平衡状态的是。
a.的浓度不变 b.混合气体的平均相对分子质量不变
c.混合气密度不变 d.断裂3mol H—H键的同时断裂2mol O—H键
②由表中数据可知,双功能的分子筛膜催化反应器模式下,的转化率明显提高,可能的原因是:。
①
②
总反应的

①分析图像可知,(填“>”“<”或“=”)0。
②温度下,若向装有足量
固体的2L恒容密闭容器中通入
, 达到平衡时,
的物质的量分数为。

①下列叙述能说明反应已达到平衡状态的是(填标号)。
A.每消耗气体,同时消耗
气体
B.的物质的量分数不再变化
C.
D.混合气体的平均相对分子质量不再变化
②在温度、容积一定的密闭容器中,用CO处理大气污染物时,增大
的投料比,CO的转化率(填“增大”“减小”或“不变”)。
③时,在2L的密闭容器中,充入6mol的
和
, 4min后容器内各物质的物质的量不再变化,0~4min,
。此时,平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果保留三位有效数字)。
反应Ⅰ:
反应Ⅱ:|
则反应
。

A.的消耗速率和
的消耗速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
②图中表示1MPa时的物质的量分数随温度变化关系的曲线是(填字母),理由是;550℃条件下,t min反应达到平衡,平衡时容器的体积为L,反应Ⅱ的
。(以分压表示,分压=总压×物质的量分数)

①某温度下,当吸收池中溶液的pH=8时,此时该溶液中[已知:该温度下
,
]。
②利用电化学原理控制反应条件能将电催化还原为HCOOH,电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移3 mol
时,阴极室溶液的质量增加g[B的电解效率
]。
①
②
③
则④
(用含
、
、
的代数式表示)。实验室可用氯化铵与消石灰反应制备少量
:
, 该反应在(填“高温”、“低温”或“任何温度”)下能自发进行。
①。
②平衡时体系压强为 ,
为用分压表示的平衡常数(分压
总压
物质的量分数),则平衡常数
(用含p的式子表示)
。

完成下列填空:
C3H8的转化率随温度升高而上升的原因是,写出一条提高C3H6产率的措施。
已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。


a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则
=。


①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“
”或“
”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
已知:CO2氧化C2H6制C2H4的主反应热化学方程式为:C2H6(g) + CO2(g)=C2H4(g) + CO(g) + H2O(g) ΔH=+177kJ·mol-1
I. C2H6(g)=C2H4(g) + H2(g) (快) ΔH1
II. CO2(g) + H2(g)= CO(g) + H2O(g) (慢) ΔH2=+42kJ·mol-1
则:①反应I的ΔH1 = kJ ·mol-1。
②已知:ΔG=ΔH- T·ΔS。当ΔG>0,反应非自发;当ΔG<0,反应自发。若反应I的ΔS=+120J·K-1·mol-1 , 反应I自发进行的最低温度T=K。
③相比于提高c(C2H6) ,提高c(CO2)对主反应总速率影响更大,其原因是。
①CH3- CH3→CH3- CH2·+ H++e- ,
②CH3-CH2·→CH2=CH2+H++e- ,
③CO2+e-→ ,
④+ H+→·COOH,
⑤ ,
则:自由基CH3-CH2·的电子式为 ,⑤的反应式为。
①其他条件相同时,1mol C2H6与1mol CO2经相同反应时间测得如表实验数据:
|
实验 |
温度/K |
催化剂 |
C2H4的产率% |
|
实验1 |
400 |
催化剂1 |
55.0 |
|
400 |
催化剂2 |
62.3 |
|
|
实验2 |
500 |
催化剂1 |
68.5 |
|
500 |
催化剂2 |
80.1 |
在催化剂相同时,温度越高C2H4产率更高的原因是 ; 相同温度时,催化剂2催化下C2H4产率更高的原因是。
②在容器体积为1.0L,充入2 mol C2H6和3 mol CO2同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。则:判断P1>P2的理由是 ;M点主反应的平衡常数为(结果保留2 位有效数字)。

①SO2(g)+2NH3·H2O(aq)=(NH4)2SO3(aq)+H2O(l) △H1
②(NH4)2SO3(aq)+SO2(g)+H2O(l)=2NH4HSO3(aq) △H2
③2NH4HSO3(aq)+2NH3·H2O+O2(g)=2(NH4)2SO4(aq)+2H2O(l) △H3
则2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=。
A.SO3和NO的浓度比保持不变
B.混合气体的颜色保持不变
C.容器中压强不再变化
D.恒容混合气体的密度保持不变

①达到平衡后,仅升高温度,k正增大的倍数(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,总压为a,在一定温度下达到平衡时,CO的转化率为50%,则=;在t1min时再向容器内加入1molCO和1molNO,保持温度不变,则再次达平衡时NO的转化率(填“增大”“减小”或“不变”)。整个过程中容器中的气压(P)与反应时间(t)的关系曲线如图所示,则用平衡分压代替平衡浓度表示的压强平衡常数Kp=。

①298K,101kPa下,下列反应
则反应能自发进行的条件是。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)。
A.在制备阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在转化为
阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
①某温度下,假设进入接触室内的物质的量恒定。当
和
的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使
的平衡转化率提高到90%,则
和
的物质的量比为应为(计算结果保留1位小数)。
②催化氧化
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:。
步骤Ⅲ:
当稀释时,
的值(增大、减小或不变),理由是。
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | H2(g)+ | 685 | 970 |
② | 2CH3OH(1) + 3O2(g)=2CO2 (g) +4H2O (1) | 3526 | 4978 |
CO2与H2合成液态甲醇的热化学方程式为。

①0~ 20 min内,用CH3OH的浓度变化表示的平均 反应速率:v(CH3OH)= mol·L-1·min-1。
②该温度下,反应的平衡常数K= (结果保 留两位小数)。
③若在上述平衡状态下,再向容器中充入1mol CO2和1molH2O(g),则反应速率 v(正)v(逆) (填“>”“< “或“= “)。


①2H2(g)+O2(g)= 2H2O(g) ΔH1= -484 kJ· mol-1
②COS(g)+ H2O(g)⇌H2S(g)+CO2(g) ΔH2= -36kJ·mol-1
③CO的燃烧热为283 kJ·mol-1
反应CO(g)+ H2S(g)⇌COS(g)+ H2(g)的 ΔH= kJ·mol-1。
+
关于该反应的下列叙述正确的是(填标号)。
A.步骤①是慢反应,活化能较大
B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物
D.更换催化剂可改变E和ΔH
+
300℃和320℃时,φ(H2S)随时间变化关系的曲线分别是、,判断的理由是。
反应Ⅰ:CO2(g)+H2(g)H2O(g)+CO(g) △H1
反应Ⅱ:CO(g)+2H2(g)CH3OH(g) △H2=-90.0kJ·mol-1
反应Ⅲ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
反应Ⅳ:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
反应Ⅴ:2CO2g)+6H2(g)C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
回答下列问题:
温度/K CO2转化率 | 500 | 600 | 700 | 800 |
1 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 40 | 22 |
①下列说法中正确的是(填英文字母)。
A.增大氢碳比,平衡正向移动,平衡常数增大
B.v(CH3OH)=v(CO2)时,反应达到平衡
C.当混合气体平均摩尔质量不变时,达到平衡
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,某时刻测得容器内CO2、H2、CH3OH、H2O的物质的量分别为2mol、2mol、1mol和1mol,则此时正反应速率和逆反应速率的关系是(填英文字母)。
A.v(正)>v(逆) B.v(正)<v(逆) C.(正)=r(逆) D.无法判断

①该催化剂在较低温度时主要选择反应(“Ⅲ”或“Ⅳ”或“Ⅴ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是:。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=L2/mol2(保留两位小数)。



①曲线Ⅰ中,a点右侧乙烯产量随温度升高而降低的原因是。
②两种催化剂比较,催化剂Ⅱ的优点与不足是。
2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq)△H=-116.1kJ·mol-1
3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l)△H=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的△H=kJ·mol-1

①投料比一定时,要提高N2O平衡转化率,可采取的措施是。
②反应达到平衡前,在同温同压条件下的相同时间段内,N2O的转化率在使用催化剂2时比使用催化剂1要高,原因是。
③在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入1molN2O、4molCO和相同催化剂,发生上述反应。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。
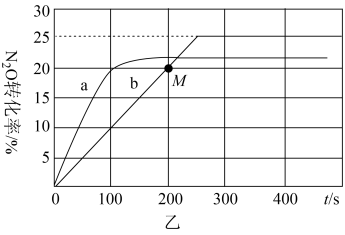
Ⅰ.曲线b中,从反应开始到M点处,用N2O表示的反应速率为mol/(L·s)。
Ⅱ.容器B中N2O的转化率随时间的变化关系是图乙中的(填“a”或“b”)曲线。

①A、B、C三点中NO2的转化率最高的是(填“A”、“B”或“C”)点,理由是。
②C点时该反应的压强平衡常数Kp=MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应I:CH4(g)+ H2O(g) CO(g) +3H2(g) △H1=+206 kJ·mol-1
反应II:CH4(g)+ 2H2O(g) CO2(g)+4H2(g) △H2=+165 kJ·mol-1
反应III:CO(g)+ H2O(g) CO2(g)+H2(g) △H3
回答下列问题:



CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=-571.6 kJ·mol-1
则③CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH=。

①若N点压强为1 MPa,则平衡常数Kp(N)=MPa-2 , P点与N点的平衡常数K(P)K(N)(填“>”、“<”或“=”)。
②若无催化剂,N点平衡转化率(填“是”或“否”)可能降至R点?理由是:。


①在A、B、C三种催化剂的作用下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C) ,根据图3曲线,判断三种催化剂条件下,活化能由小到大的顺序为。
②在氨气足量时,反应在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图4所示,据图可知,在相同的时间内,温度对脱氮率的影响是,其可能的原因是(已知A、B催化剂在此温度范围内不失效)。
t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
p/kPa | 400 | 370 | 346 | 330 | 320 | 320 |
假设反应在恒定温度和标准压强下进行,则= (标准平衡常数
, 其中
为标准压强(1 ×105 Pa),
和
, 为各组分的平衡分压,如
=
·p总 , p总为平衡总压,
为平衡系统中NO的物质的量分数)。
