①N2(g)+O2(g) 2NO(g) △H1=+179.5 kJ·mol-1
②NO2(g)+CO(g) NO(g)+CO2(g) △H2=-234 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) △H3=-112.3 kJ·mol-1
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3 , 则该反应的K=用K1、K2、K3表示)
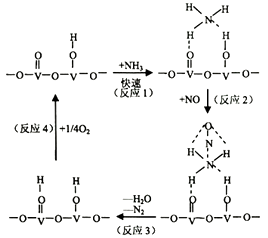
①写出总反应化学方程式。
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是反应(填“吸热”或“放热”)。
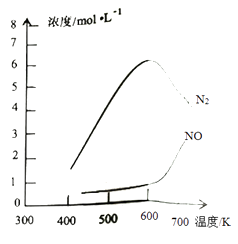
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为;当温度达到700K时,发生副反应的化学方程式。
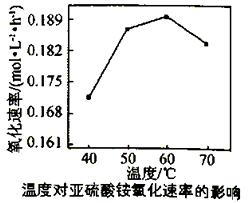
试解释在温度较高时,(NH4)2SO3 氧化速率下降的原因是;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH4+)前者(填“大”小”)