1.
(2018·贵阳模拟)
我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:
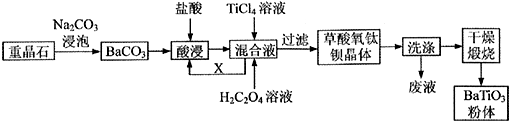
查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10 , Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
-
(1)
工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3 , 该过程用离子方程式可表示为,此反应的平衡常数K= (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
-
-
-
-
(3)
配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是。
-
-
(4)
可循环使用的物质X 是(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:。
-
-
(5)
煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、和(填化学式)。
-
