

方法Ⅰ甲醇水蒸气重整制氢:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH1= +49.4kJ/mol
方法Ⅱ甲醇氧化重整制氢: CH3OH(g)+ O2(g)
CO2(g)+ 2H2(g) ΔH2=-192.4 kJ/mol
方法Ⅲ甲醇分解制氢:CH3OH(g) CO(g)+2H2(g) ΔH3

①温度为250℃、压强为P2时,反应达平衡时H2的体积分数为;
②图中的压强由小到大的顺序是,理由是。
a.v正(CO)=2v逆(H2)
b.体系的平均摩尔质量不再改变
c.H2的浓度保持不变
d. △H不再改变
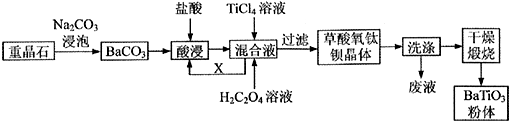
查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10 , Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:

①装置Ⅰ中盛放浓硫酸的仪器名称为;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是;裝置Ⅳ的作用是,盛装的试剂为。

①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因。
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为g·L-1 , 该数据说明某葡萄酒中SO2的残留量 (填“是”或“否”)达到我国国家标准。
A | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
B | 基态原子的p轨道电子数比s轨道电子数少1 |
C | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第7纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:

①与新制的Cu(OH)2发生反应,生成砖红色沉淀;
②与NaHCO3溶液反应产生CO2气体;
③无支链。