1.
(2018·郴州模拟)
醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
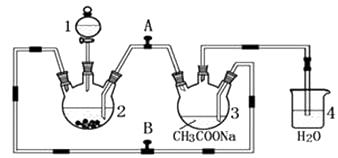
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
-
-
-
(2)
往仪器2中加盐酸和三氯化铬溶液的顺序最好是
(填序号);目的是
。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
-
-
(3)
为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门(填“A”或“B",下同),打开阀门。
-
-
(4)
本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是。
-
-
(5)
已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物)。
-
-
(6)
铬的离子会污染水,常温下要除去上述实验中多余的Cr
2+ , 最好往废液中通入足量的
,再加入碱液,调节pH至少为
才能是铬的离子沉淀完全(铬的离子浓度应小于10
-5mol/L)。【已知Cr(OH)
3的溶度积为6.3×10
-31 ,

≈4,lg2≈0.3】
-
