A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
①该反应体现出酸性关系: H3PO4 H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,。
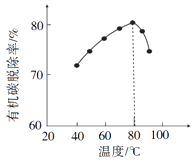

反应Ⅲ: S(s)+O2(g)=SO2(g) △H3=-297 KJ·mol-1
反应Ⅱ的热化学方程式:。

i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+ =+ +2I-

①B是A的对比实验,则a=。
②比较A、B、C,可得出的结论是。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:。
资料:K2FeO4为紫色固体,微溶于KOH溶液:具有强氧化性,在酸性或中性溶液中快速产生O₂,在碱性溶液中较稳定。

①A为氯气发生装置。A中反应方程式是(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 。
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有。
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2 , 为证明是否K2FeO4氧化了Cl-而产生Cl2 , 设计以下方案:

Ⅰ.由方案Ⅰ中溶液变红可知a中含有离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl- , 用KOH溶液洗涤的目的是。
②根据K2FeO4的制备实验得出:氧化性Cl₂ (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
的氧化性强弱关系相反,原因是。
③资料表明,酸性溶液中的氧化性 >MnO4- , 验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
> MnO4- , 若能,请说明理由;若不能,进一步设计实验方案。理由或方案:。