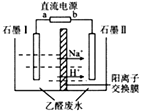
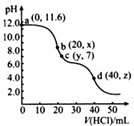
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断错误的是( )
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是。
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=;k=。
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=kJ/mol;K3=(用K1和K2表示)。
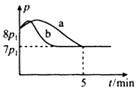
反应原理:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
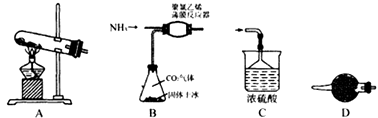
装置A中发生的化学反应方程式为。
有人提出利用下列装置代替聚氯乙烯薄膜反应器。
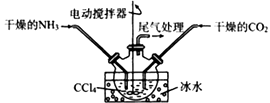
该装置的优点是、。结合化学反应方程式解释不能用水代替CCl4的原因是;当大量固体物质悬浮于CCl4上时即可停止反应,分离出产品的方法是。
已知,制备过程中因温度控制不当,在150℃时会产生尿素。如果对参加反应的气体干燥不彻底可能会有NH4HCO3、(NH4)2CO3杂质生成。
①请设计简单实验方案探究上述产物中是否有尿素。
②请设计定量实验方案探究上述产物(假设不存在NH4HCO3)中是否有碳酸铵。
(以上方案均不需详细描述实验步骤,限用试剂:蒸馏水、Ba(OH)2溶液;仪器自选)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键。
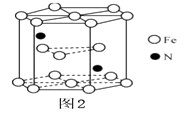 ,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ①常温下,与碳酸钠溶液反应放出气体;
②能发生银镜反应。则符合条件的X共有种。其核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则X的结构简式为。
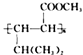 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。