


①将乙醇和乙酸、稀硫酸共热制乙酸乙酯
②无水乙醇和浓硫酸共热到140℃制乙烯
③验证RX是氯代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液出现褐色沉淀
④做还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶被水浴加热后未析出银镜
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液水浴加热后未析出银镜

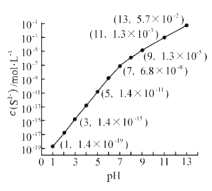
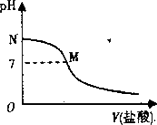
①pH = 13 时,溶液中的 c(H2S) +c(HS-) =mol•L-1;
②某溶液含0.020mol•L-1Mn2+0.10mol•L-1H2S,当溶液pH = 时,Mn2+开始沉淀(已知:[Ksp( MnS)=28×10-13)。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为;
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为;

①充入NH3时,混合气体的密度将,在达到平衡的过程中,混合气体的密度将(填“增大”、“减小”或“不变”);反应重新达平衡的混合气体对氢气的相对密度将5(填“ >”、“ <”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡 ;
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当K( N2):V( H2):F( NH3) = 1:3:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式:。


①浸取反应中氧化剂的化学式为;滤渣I的成分为MnO2、S和(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过mol/L。(已知Ksp[Cu(OH)2] =2.2×10-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式。
④滤液Ⅱ经蒸发结晶得到的盐主要是(写化学式)。
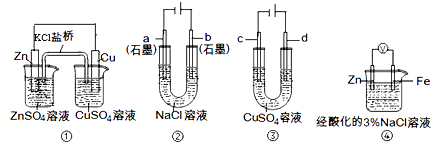
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了 mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差g。

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH (填“减小”、“增大”或“不变”),乙池中石墨为极(填“正”、“负”、“阴”或“阳”)
a.B,C,D的原子半径由大到小的顺序为:D >C >B
b.E,F的最外层电子数相等
c.A,B,C,D四种元素中电负性和第一电离能最大的均为B
d.B与C形成的化合物中可能含有非极性键
e.A,C,F都位于周期表的3区
a. NH3
b. SO32-
c.NO3-
d.PCl3

a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽搏水解生成互为同分异构体的葡萄槠和果糖
c.用银镜反应不能判新淀粉水解足否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物

已知:I.醛与醛能发生反应,原理如下:

Ⅱ.烃A在标准状况下的密度为1.25g/L。
请回答:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴生加成反应