H2(g)+ O2(g)=H20(1) △H1=-286kJ·mol-1
H2(g)+ O2(g)=H2O2(l) △H2=-188 kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=kJ·mol-1。不同温度下
过氧化氢分解反应的平衡常数K313KK298K (填“大于"“小于”或“等于”)。
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% |
无 | __ | 2 | Fe3+ | 1.O | 15 |
Al3+ | 10 | 2 | Cu2+ | O.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是。贮运过氧化氢时,可选用的容器材质为(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁

2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=kJ·mol−1。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为mol。
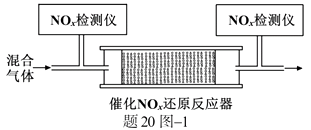
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图−1)。
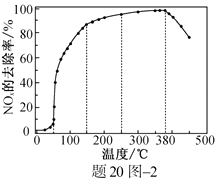
反应相同时间NOx的去除率随反应温度的变化曲线如题20图−2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是。
已知:
该催化重整反应的
。有利于提高
平衡转化率的条件是(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时
的转化率是50%,其平衡常数为
。
积碳反应 | 消碳反应 | ||
75 | 172 | ||
活化能/ | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂XY(填“优于或劣于”),理由是.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是(填标号)
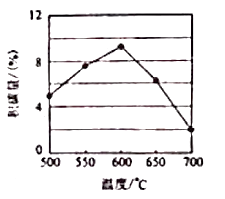
A.K积、K消均增加
B.V积减小、V消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
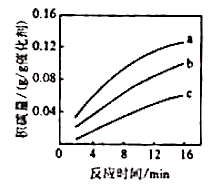
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在
一定时,不同
下积碳量随时间的变化趋势如右图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为