目的 | 操作 | |
A. | 制备氢氧化铁胶体 | 将饱和氯化铁溶液滴入氢氧化钠稀溶液中并加热 |
B. | 除去CO2中混有的少量SO2 | 将混合气体通过盛有饱和碳酸钠溶液的洗气瓶 |
C. | 测定新制氯水的pH | 用玻璃棒蘸取溶液,点在pH试纸上,与标准比色卡对比 |
D. | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸靠近试管口,观察试纸颜色变化 |
![]()

量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
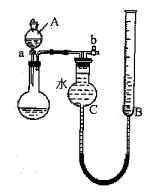
①仪器A的名称是。
②读数前,应进行的操作是。
③该方案存在较大的误差,可能的一种原因是。
a.Na2SO3溶液
b.双氧水
c.硝酸钠溶液
d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式。
③该方案中,操作I包含的操作名称依次为。

②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为 mol ·L-1。

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
写出反应I中含铍化合物与过量盐酸反应的离子方程式
a加入过量的 NaOH
b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是。
②若用浓HNO3溶解金属硫化物,缺点是 (任写一条)。
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=。(用含a、b、c、d的代数式表示)

①该反应的△H0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是 (填标号)。
A.降低温度
B.减小容器的体积
C.使用新型催化剂
D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2 , 10min时达到平衡,则v(Cl2)为mol·〔L·min)-1 , 平衡常数K为,保持温度不变,减小投料比 ,K值将 (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是。
 ,回答下列问题:
,回答下列问题:

①苯环上一氯代物有2种
②分子式为C8H10O2
③既能与FeCl3溶液发生显色反应又能与溴水发生加成反应
④1mol化合物B与足量金属钠反应生成标准状况下氢气22.4L
①氧原子数与B相同但相对分子质量比B少36
②能发生水解反应
其中核磁共振氢谱只有2组峰的是 (写结构简式)