
B . C919客机升空
B . C919客机升空 
C . 复兴号列车高速行驶
C . 复兴号列车高速行驶 
D . 蛟龙号深潜器下潜
D . 蛟龙号深潜器下潜 
 B .
B .  C .
C . 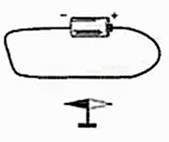 D .
D . 



资料1:2KMnO4 + 5 H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 10CO2↑
资料2:通常情况下,反应物浓度变大,反应加快;温度升高,反应加快。
假设一:褪色速度突然加快是由反应物浓度变大引起的;
假设二:褪色速度突然加快是由反应过程中温度升高引起的;
小明经过分析,否定了假设一,理由是。
把经过硫酸酸化的高锰酸钾溶液等分为两份,分装A、B两试管,同时向两支试管中加入等量等浓度的草酸溶液,并置于同一水浴中。迅速向A试管中加入一定量的MnSO4 , 发现A试管中溶液褪色明显快于B试管。上述实验中,把2支试管置于用一水浴中的目的是。这一实验基于的假设是。
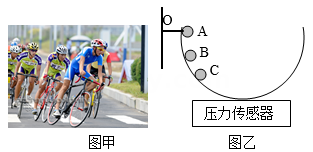
接着,小华和小丽一起设计实验,并在实验室里通过实验验证猜想一。
把半径为0.5米的半圆轨道(左端连着横杆)通过横杆在O点与墙壁活动连接(能绕O点在竖直方向自由转动),轨道置于压力传感器上时,传感器示数为1牛。让质量为30克的同一小钢球分别从距离传感器表面不同高度的弧面A、B、C三处自由滚下,如图乙所示。观察、记录每次压力传感器达到的最大示数(注:小钢球到达最低点时的示数最大),记录如下表。
| 小钢球初始位置 | A | B | C |
| 距压力传感器高度/米 | 0.5 | 0.4 | 0.3 |
| 压力传感器达到的最大示数/牛 | 1.90 | 1.78 | 1.66 |
该实验可以得出的结论是。
若要验证猜想二,从控制变量角度考虑,需对上述实验进行哪两项改变?(不考虑小钢球与轨道之间的摩擦)①;②。
实验后,他俩在与同学们的交流中,有了新的猜想:让骑行的自行车转弯需要的力还可能与人和车的总质量有关。于是,他俩又展开了后续实验探究……
