

A | B | C | D | |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |

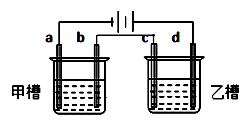
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组 | A | B | C | D |
甲槽 | NaOH | Cu(NO3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
①再加入30mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.





TaS2(g)+2I2(g) TaI4(g)+S2(g)

下列说法正确的是 ( )

①A极的质量增重mg ②B极的质量增重mg
②N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:

②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1T3(填“>”“<”“=”),此正反应是反应(填“放热或吸热”)。

图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(提示:272 = 729)
