
要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 | 离子反应 |
A | 向FeCl2溶液中加入Zn片 | 浅绿色溶液变为无色 | Zn具有还原性 | Fe2++Zn═Zn2++Fe |
B | 向FeCl2溶液中滴新制氯水 | 浅绿色溶液变为棕黄色 | Fe2+具有还原性 | 2Fe2++Cl2═2Fe3++2Cl﹣ |
C | 向FeCl3溶液中加入铁粉 | 棕黄色溶液变为浅绿色 | Fe具有还原性 | Fe+Fe3+═2Fe2+ |
D | 向FeCl3溶液中加入铜粉 | 蓝色溶液变为棕黄色 | Fe3+具有氧化性 | Fe3++Cu═Fe2++Cu2+ |
 向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
往氯化铁溶液中滴加氢氧化钠溶液,现象是
往氯化铁溶液中滴加硫氰化钾溶液,现象是
往氯化铝溶液中滴加氢氧化钠溶液至过量,现象是.
用此溶液分别做如下实验:取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为,此反应属于(填反应类型).
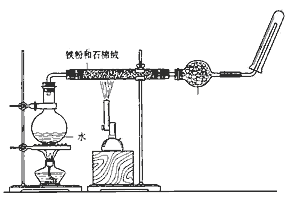
为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
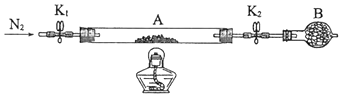
①仪器B的名称是.
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
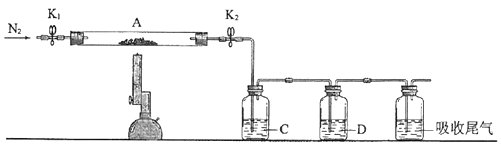
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为.
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式.

请根据以上信息回答下列问题:
I.回答下列有关问题:
写出符合下列条件的离子符号:既能被氧化又能被还原的离子是,加铁粉后溶液增重的是 (填写离子符号)
请计算: