第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是 ( )

下列说法不正确的是( )
| 温度/ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
则下列关于原溶液的判断正确的是( )
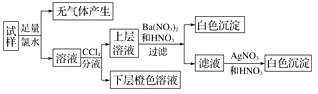
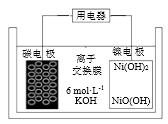
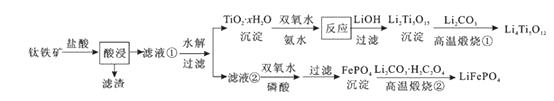
。
某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。请回答:
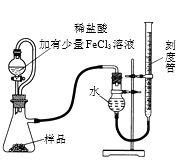
再平视刻度线读数。
反应I:C4H8 (g) ![]()
C3H6(g) ΔH1
反应II:C4H8(g) ![]() 2C2H4 (g) ΔH2
2C2H4 (g) ΔH2
①已知烃的裂解是吸热反应,则ΔH1ΔH2(填“>”、 “=”或“<”)。
②若某温度下反应达到平衡时C4H8、C3H6、C2H4的体积分数分别为20%、70%、10%,平衡时总压强为P,请计算该温度下反应II的平衡常数Kp=(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
①下图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
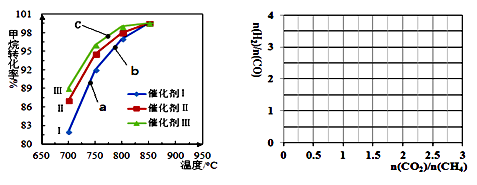
下列说法正确的是。
A.在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B.b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C.C点一定未达到平衡状态
D.催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
②催化剂Ⅰ也可以催化甲烷-二氧化碳重整。在催化剂Ⅰ催化下,反应温度850 oC ,n(H2O)/n(CH4)为1的体系中,加入CO2。画出反应达到平衡时n(H2)/n(CO)随进料时n(CO2)/n(CH4)的变化曲线。(已知:甲烷-二氧化碳重整的平衡常数>>甲烷-水蒸气重整反应的平衡常数) 。
①阳极的电极反应式为。
②电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为L。(乳酸的摩尔质量为90g/ mol )
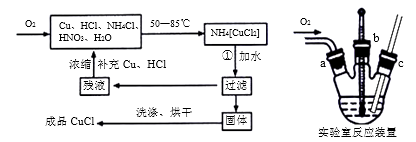
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
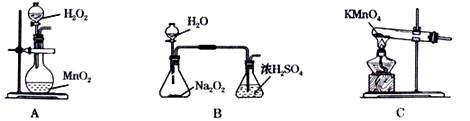
①称取成品0.25g置于预先放入玻璃珠30粒和10mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为。
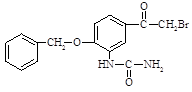
②苯环上有羧基或酯基时,新取代基主要在间位。
结合上述合成路线,请设计以乙苯、ClCH2OH、(CH3)2NH为原料合成 ![]() 的合成路线(用流程图表示,无机试剂任选),示例如下:
的合成路线(用流程图表示,无机试剂任选),示例如下:
![]()
①有苯环;②核磁共振氢谱有4个峰。