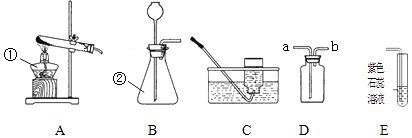
 点燃酒精灯
B .
点燃酒精灯
B .  取用二氧化锰
C .
取用二氧化锰
C .  加入锌粒
D .
加入锌粒
D . 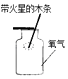 氧气验满
氧气验满
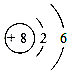 C .
C . 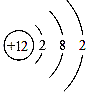 D .
D . 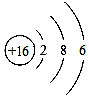

A | B | C | D |
|
|
|
|
既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素 | 既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧 | 既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的 | 既可探究可燃物的燃烧条件,又说明红磷不是可燃物 |
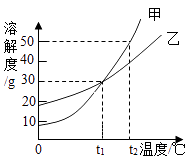
若选择充满水的D装置收集O2 , 气体应从(填a或b)通入.
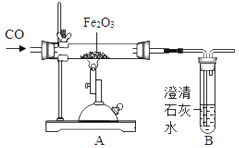
①“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液.所得溶液中溶剂是.
②用“捕捉”CO2生产甲醇,反应的微观示意图如下:
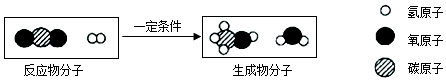
该反应的化学方程式为.
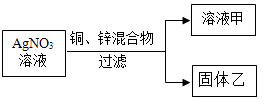
①若乙中含有锌、铜、银三种固体,则溶液甲中所含的溶质为(填化学式),此时向固体乙中加入稀盐酸,发生反应的化学方程式为,所属基本反应类型为反应.
②若溶液甲显蓝色,此时固体乙中可能含有的物质是.
A.锌、铜、银 B.只有铜和银 C.只有锌和银 D.只有银.
请回答:
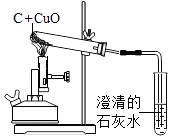
【提出问题】实验得到的红色固体全是Cu吗?
【查阅资料】①氧化亚铜(Cu2O)是红色的;
②氧化亚铜不溶于水,与稀硫酸反应生
成蓝色溶液.反应的化学方程式为:
Cu2O+H2SO4=Cu+CuSO4+H2O
【猜 想】a.红色固体只有Cu;
b.红色固体只有Cu2O(Cu2O中铜与氧两种元素的质量比为);
c.红色固体是Cu与Cu2O的混合物.
【实 验】①取适量红色固体加入试管中;
②向其中滴加足量稀硫酸;
③振荡,使其充分反应;
④静置;
⑤观察到溶液显蓝色,.
【实验结论1】通过上述实验判断,与之相符的猜想为(填猜想序号).
【继续实验】称取14.4g原红色固体,倒入烧杯中,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥,得固体13.6g.
【实验结论2】原红色固体中氧化亚铜质量为 g.