
选项 | 生活现象或实验现象 | 解释 |
A | 用金属铝做高压线电线,而不用金属银 | 铝价钱低、密度小、易导电、抗腐蚀性强等 |
B | 咸菜晾晒时,表面有白色食盐析出 | 溶剂蒸发饱和时有晶体析出 |
C | 铁锈不与氧气反应,但却加快铁生锈速率 | 铁锈疏松多孔,易吸收水分 |
D | 食盐溶于水不溶于豆油 | 食盐溶解与加入溶剂多少有关 |
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | NaCl | 35.0 | 35.5 | 36.0 | 36.5 | 37.0 |
Na2CO3 | 6.0 | 10.0 | 18.0 | 36.5 | 50.0 | |

①t1℃时,溶解度相等的两种物质是.
②B的饱和溶液中混有少量的物质A,要除去A得到较纯的B物质,可采用的结晶方法是.
③如图2所示,在大烧杯中加入一定量的硝酸铵固体后,甲试管内出现的现象是,乙试管内的溶液为溶液(填“饱和”或“不饱和”).
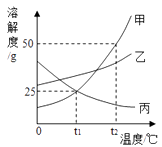
①t1℃时,甲的溶解度为;
②现有甲、乙、丙三种物质的浓溶液,适用海水晒盐原理进行结晶提纯的是;
③t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是;
④下列说法正确的是.
A.t2℃时把50g甲放入50g水中所得到甲的饱和溶液中溶质与溶液的质量比为1:2
B.t2℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
C.t1℃时,甲、乙、丙三种溶液分别升温,其浓度都不可能发生变化
D.t1℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
E.t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,这三种溶液的溶质质量分数的大小关系是乙>甲=丙
F.t1℃时,甲、乙、丙三种溶液的浓度可能相等.
|
|
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
KNO3 |
13.3g |
31.6g |
63.9g |
110g |
169g |
246g |
|
NaCl |
35.7g |
36.0g |
36.6g |
37.3g |
38.4g |
39.8g |
A.溶液中各部分的性质相同
B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液
D.溶液加水稀释后溶质的质量变小
离子 | OH- | Cl- | CO32- | SO42- | |||||
K+ | 溶 | 溶 | 溶 | 溶 | |||||
Mg2+ | 不 | 溶 | 微 | 溶 | |||||
.Ba2+. | 溶 | 溶 | 不 | ||||||
温度 (℃) | 0 | 10 | 20 | 30 | 40 | ||||
氯化钠(g) | 35 | 35.5 | 36 | 36.5 | 37 | ||||
碳酸钠(g) | 6 | 10 | 18 | 36.5 | 50 | ||||
表1空格中应填写;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是。
某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,下图是粗盐提纯实验的操作示意图。

请回答下列问题:
① 下列说法错误的是
A.此实验只能除去不溶性的杂质
B.称量粗盐是为了计算产率和计算量取水的体积
C.操作F时若滤纸没有紧贴漏斗内壁,则会影响过滤速度
D.蒸发结晶时,蒸发皿应放在石棉网上加热
② 操作C中用玻璃棒的作用是。
③ 操作F的错误是,本操作完成后若发现滤液仍然浑浊,但滤纸未破损,可能的原因是。(写一条)
④ 粗盐提纯实验的操作顺序为(填操作字母)、称量精盐并计算产率。
⑤ 操作D中,当观察到时,停止加热。