 B .
B .  C .
C .  D .
D . 
 B .
B .  D .
D . 
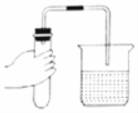 检査气密性
B .
检査气密性
B . 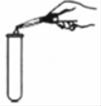 添加大理石
C .
添加大理石
C .  收集
D .
收集
D . 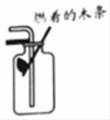 验满
验满
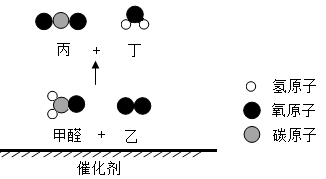
①蔗糖;②饮料;③爆竹;④汽油;⑤香烟

| 选项 | 实验目的 | 实验方案 |
| A | 除杂:N2中混有O2 | 通过灼热的铜网 |
| B | 分离:水和泥沙 | 用活性炭吸附 |
| C | 检验:CO2中含有的水蒸气 | 通过无水硫酸铜 |
| D | 区别:硬水和软水 | 用肥皂水区分 |

| | | | |
| A.探究空气中氧气含量 | B.验证甲烷(CH4)燃烧生成二氧化碳和水 | C.探究铁、铜的金属活动性强弱 | D.称量固体药品 |

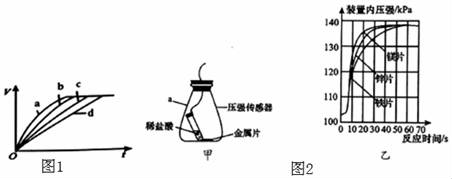
请在图二中作出随着时间的变化甲中生成O2质量的关系曲线(在答题卡中画出)。
①点燃酒精灯,给试管加热;②熄灭酒精灯;③检查装置的气密性;
④将氯酸钾和二氧化锰的混合物装入试管中,并连好导管,将试管固定在铁架台上;
⑤用排水集气法收集氧气;⑥将导管从水槽中取出。
2Na2O2(固体)+2H2O═4NaOH+O2↑(如图三所示),实验室中可用装置来模拟其制取过程(选填字母序号)。


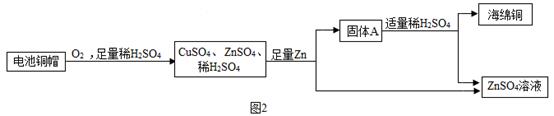 已知:2Cu+2H2SO4+O2
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
根据上述信息,可推得:固体A的成分是(写化学式);它属于(选填“纯净物”或者“混合物”),过程①②③中发生了相同化学反应,其化学方程式为,过程②中分离操作的名称是;实验室中进行该操作,常用的玻璃仪器除了烧杯和漏斗,还有。
a.50℃、铁粉
b.30℃、铁粉
c.30℃、铁丝
d.20℃、铁丝
请写出铁与盐酸反应的化学方程式:,该反应进行时会放出热量。
①该实验中,你认为还需要控制的变量是;
②根据乙图,得出反应物的量与生成H2体积的关系是。
。
|
第1份 |
第2份 |
第3份 |
第4份 |
|
|
大理石样品质量(g) |
3.0 |
3.0 |
3.0 |
3.0 |
|
稀盐酸质量(g) |
5.0 |
10.0 |
15.0 |
20.0 |
|
产生气体质量(g) |
0.44 |
0.88 |
0.99 |
X |
回答下列有关问题: