①禁止使用一切化石燃料
②结合当地资源实况,开发利用风能、水能等淸洁能源
③监控工业废水、生活污水的排放
④用密目网覆盖建筑工地内裸土以减少扬尘.
 尼龙背包
B .
尼龙背包
B .  铁锅
C .
铁锅
C .  金刚石薄膜
D .
金刚石薄膜
D .  木梳子
木梳子
 液化气站
B .
液化气站
B .  农产品批发市场
C .
农产品批发市场
C .  面粉厂
D .
面粉厂
D .  电影院等娱乐场所
电影院等娱乐场所


①两个硅原Si2②3个氮分子3N2③5个硫酸根离子5SO4﹣④氧化铜CuO2⑤+6价的硫元素 .
选项 | 类别 | 物质 |
A | 合金 | 钢、焊锡、生铁 |
B | 盐 | 食盐、火碱、生石灰 |
C | 有机物 | 甲烷、乙醇、葡萄搪 |
D | 腐蚀性物质 | 浓硫酸、氢氧化钠 |
①机动车推广使用乙醇汽油;
②液化石油气罐中残留液体倒入下水道;
③为降低居室甲醛含量,新装修住房应紧闭门窗,并放置一盆水;
④虾仁等水产品用甲醛的稀溶液进行处理,延长保鲜时间;
⑤节日大量燃放烟花爆竹,增加喜庆气氛.
选项 | 化学反应事实 | 影响因素 |
A | CO2和H2O在光照条件下生成葡萄糖,而CO2溶于H2O却生成碳酸 | 反应条件 |
B | 碳在氧气充足时燃烧产物是CO2 , 在氧气不足时燃烧产物是CO | 反应物的量 |
C | 氯酸钾在加热时反应较慢,而在加入二氧化锰后迅速分解 | 催化剂 |
D | 在“空气中氧气含量的测定”实验中,用铜粉加热而不用铜片 | 反应物种类 |
 探究的是分子之间是否有间隔的
B .
探究的是分子之间是否有间隔的
B .  探究的是金属的锈蚀是否需要水
C .
探究的是金属的锈蚀是否需要水
C .  探究的是MnO2对H2O2分解的催化作用
D .
探究的是MnO2对H2O2分解的催化作用
D .  探究的是可燃物燃烧是否需要与氧气充分接触
探究的是可燃物燃烧是否需要与氧气充分接触
 常温下,向一定量的饱和石灰水中加入氧化钙
B .
常温下,向一定量的饱和石灰水中加入氧化钙
B .  氧气的溶解度随温度的变化
C .
氧气的溶解度随温度的变化
C .  向一定质量的过氧化氢的水溶液中加入二氧化锰
D .
向一定质量的过氧化氢的水溶液中加入二氧化锰
D .  一定质量的浓盐酸敞口放在空气中
一定质量的浓盐酸敞口放在空气中
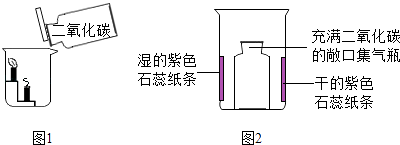


综上分析在验证质量守恒定律时,有气体参加或生成时要保持;
①分子种类②原子种类③分子数目④原子数目⑤元素种类⑥物质的总质量

在蒸发池中促进水分蒸发,主要是利用了下列各项中的(填选项序号)
①潮汐能②生物能③电能④太阳能⑤化学能
![]()
在上述转化过程中,①处发生的反应属于反应.(填“中和”或“复分解”或“化合”或“分解”)
①t1℃时,KCl饱和溶液的溶质质量分数 KNO3饱和溶液的溶质质量分数(填“大于”或“小于”或“等于”);
②已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g,在20℃时,向盛有200g水的烧杯中加入80gKNO3 , 充分溶解,得到该温度时KNO3的(填“饱和”或“不饱和”)溶液;
③若KNO3固体中混有少量杂质为固体,则分离除去KCl的方法是.


甲 | 乙 | 丙 | 丁 | |
大理石M克 | 块状 | 块状 | 粉末状 | 粉末状 |
盐酸(足量)N克 | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
①若要研究盐酸浓度大小对反应的影响,可选择实验甲与对照(填编号);
②除盐酸的浓度外,上述实验研究的另一个影响反应的因素是
③综合分析,你认为反应最剧烈的是(填编号),在实验室吸收二氧化碳的方法是(用化学方程式表示).
如表是A、B、C三种金属的部分物理性质.
性质 金属 | 导电性(100为标准) | 密度(g/cm3) | 熔点(℃) | 硬度(10为标准) |
A | 99 | 8.92 | 1083 | 3 |
B | 61 | 2.70 | 660 | 2.9 |
C | 17 | 7.86 | 1535 | 5 |
①高压输电线不用金属A而选用金属B,主要原因是.
②C的合金通常可以做菜刀、锤子等,其合金的硬度 5(填“>”“<”或“=”).
材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:
Ni+H2SO4═NiSO4+H2↑.
写出Ni与CuSO4溶液发生置换反应的方程式.
