
| 选项 | I中试剂 | II中试剂及现象 | 推 断 |
| A | 铁粉与湿棉花 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
| B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油分解产物中含有不饱和烃 |
| D | 氯化铵 | 酚酞溶液不变红色 | 氯化铵不分解 |


①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:


下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
| Al3+ | Fe3+ | Fe2+ | Mn2+ | Co2+ | |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.7 | 7.6 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.8 | 9.2 |
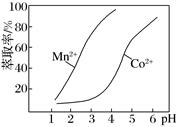
请补充完整由“氧化”后的溶液制备CoCO3的实验方案:向“氧化”后的溶液中加入,得较纯CoCl2溶液,加入NH4HCO3溶液沉钴得CoCO3。(实验中须使用试剂:Na2CO3溶液、金属萃取剂、盐酸)。

①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)。
②温度升高,副反应更容易发生的主要原因是。

①104 Pa时,图中表示丙烯的曲线是(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=(已知:气体分压=气体总压×体积分数)。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为。
②298 K 时,该工艺总反应的热化学方程式为。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是。

Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为,Cu3N 的密度为 g·cm-3。(阿伏加德罗常数用NA表示)