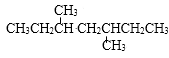 的单炔烃有( )
的单炔烃有( )

 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
| 实验目的 | 实验方法 | |
| A. | 证明海带提碘实验中有碘生成 | 浸出液中加入足量氯水再加入少量淀粉溶液 |
| B. | 检验FeSO4溶液是否完全变质 | 试样中滴酸性KMnO4溶液 |
| C. | 实验室制取溴苯 | 光照苯和液溴的混合物 |
| D. | 除去乙烷中的乙烯气体 | 催化加热条件下与H2反应 |
回答下列问题:


a.v生成(CO2)=v消耗(CO)
b.混合气体的平均相对分子质量不再改变
c.平衡常数保持不变
d.NO、CO、N2、CO2的浓度均不再变化


完成下列填空:
已知:
i. ![]()
请完成合成路线中的:ClCH2CH=CH2→甲→乙→丙。
回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;……。
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;……。

a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯

通入NH3的作用是(选填编号)。操作a是,操作b是。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3 , 提高析出的NH4Cl纯度