 过滤
B .
过滤
B .  称取氯化钠
C .
称取氯化钠
C . 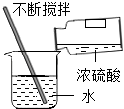 稀释浓硫酸
D .
稀释浓硫酸
D .  测溶液的pH值
测溶液的pH值
| A.化学与技术 | B.化学与能源 |
| ①用钛镍形状记忆合金制成人造卫星天线 ②用扫描隧道显微镜获得苯分子图像 ③用催化净化装置促进汽车尾气中有害气体的转化 | ①氢能源是一种广泛使用的能源 ②可燃冰将成为未来新能源 ③倡导大量使用高硫煤做燃料 |
| C.化学与医药 | D.化学与生产 |
| ①用氧气进行医疗急救 ②用生石灰做补钙剂 ③用干冰作血液制品冷藏运输的致冷剂 | ①用硫酸钠配制波尔多液 ②用食盐的水溶液制造氢氧化钠 ③用铁矿石、焦炭和石灰石炼铁 |

选项 | 物质 | 杂质 | 除杂方法 |
A | CaCO3固体 | CaO | 加足量稀盐酸,过滤 |
B | HCl气体 | H2O | 通过氢氧化钠固体,收集 |
C | NaOH溶液 | Na2CO3 | 加入足量的石灰水,过滤 |
D | MnO2 | NaCl固体 | 溶解、过滤、洗涤、烘干 |
 向硝酸钾的饱和溶液中加入氯化钠
B .
向硝酸钾的饱和溶液中加入氯化钠
B .  将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C .
将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C .  水的电解
D .
水的电解
D .  盐酸和氯化铁混合溶液中加入过量的氢氧化钠溶液
盐酸和氯化铁混合溶液中加入过量的氢氧化钠溶液


碳元素的原子核内质子数为,它属于(填“金属”或“非金属”)元素
下列物品中,禁止带上飞机的是________。
飞机餐的食品包括:米饭、鸡肉、海带、牛奶等,其中富含糖类的是,糖类物质在人体的消化系统中经酶的催化作用,最终变为葡萄糖,葡萄糖的化学式为:。

仪器 a 的名称。
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI + O2 + 2CO2 = 2K2CO3 + 2I2
乙:4KI + O2 + 2H2O = 4KOH + 2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
(实验过程)
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
① 石灰水变浑浊的原因是(用化学方程式表示)。
② 化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是。

③ 据此现象,可得出的结论是 。

化学小组据此改进实验,很快观察到固体泛黄的现象。
(实验结论)④ 根据上述实验,化学小组得出结论,碘化钾固体泛黄变质是碘化钾与共同作用的结果。

过氧化镁(其中氧元素的化合价为)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式。
下图是利用碱式碳酸镁(Mg2( OH)2CO3)和30%的过氧化氢溶液来制取过氧化镁。

(资料)
①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳
②氧化镁与过氧化氢反应放出大量的热
检测煅烧过程碱式碳酸镁完全分解的方法是


在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
①检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
稀盐酸中放入的少量硫酸铜溶液目的是。
