 B .
B .  C .
C .  D .
D . 

 B . CO2性质检验
B . CO2性质检验  C . 添加酒精
C . 添加酒精  D . 制取CO2并验满
D . 制取CO2并验满 
| A.物质的分类 | B.物质的检验 |
| 冰水、雨水和蒸馏水都是混合物 消石灰、纯碱和烧碱都是碱 | 用灼烧的方法能区别棉花和羊毛 用酚酞试液能区分熟石灰和氢氧化钠 |
| C.化学与生活、生产 | D.“低碳经济”的措施 |
| 用甲醛溶液浸泡海产品保鲜 硫酸铵不能与草木灰(碱性物质)混合施用 | 减少煤、石油和天然气等化石燃料的使用 鼓励乘坐公交车出行,倡导低碳生活 |
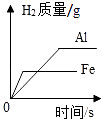 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B .
等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B . 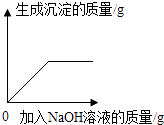 向H2SO4和MgSO4的混合溶液中滴加NaOH溶液
C .
向H2SO4和MgSO4的混合溶液中滴加NaOH溶液
C .  向pH=13的氢氧化钠溶液中不断加水稀释
D .
向pH=13的氢氧化钠溶液中不断加水稀释
D . 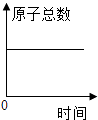 化学反应中,原子总数随时间的变化
化学反应中,原子总数随时间的变化

图示中属于单质的物质名称是;图示所表示的反应的化学方程式为,该反应属于基本反应类型中的反应。

①稀H2SO4 ②FeSO4溶液 ③Cu(NO3)2溶液 ④AgNO3溶液
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
KNO3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
202 |
246 |
|
NaNO3 |
80 |
87 |
95 |
103 |
114 |
125 |
136 |
150 |
163 |
170 |

请回答:

(查阅资料:Cu2O是红色固体,它与稀硫酸的反应为:Cu2O+H2SO4=CuSO4+Cu+H2O)
写出其中1个反应的化学方程式。

选用装置D来进行制取时,通常要在试管口处放上。
若用该反应来制取CO,制气装置应选(填字母)和C进行组合;除去其中的CO2可选仪器A和C进行组合,C中最好装入下列试剂中的(填小写字母)。
a.烧碱溶液 b.浓硫酸 c.澄清石灰水
澄清石灰水变浑浊,同时试管口有水珠生成。
当导管口不再有气泡产生时,试管内仍有白色固体,她猜测
剩余固体可能是:

①NaOH; ②Na2CO3; ③NaCl。
小刚认为猜想一定不正确,理由是。
小刚从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,他判断该固体为NaOH,小美认为他的实验设计不合理,因为
操作步骤 | 实验现象 | 结论 |
取少量白色固体于试管中,加水溶解,向其中滴加溶液 | 产生白色沉淀 | 试管内剩余的固体为Na2CO3 |
小美和小刚继续探究固体成分,设计了如下实验:
通过实验证明小苏打受热会分解,反应的化学方程式为:。通过本次探究学习,小美对小苏打的性质有了全面的认识:
她给妈妈提出保存小苏打的建议有: (答出一点即可)。

将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
