| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.086 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| 选项 | 操作 | 所选仪器 |
| A | 称取3.0 g的干海带 | 托盘天平 |
| B | 灼烧干海带至完全变成灰烬 | 蒸发皿 |
| C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
| D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
①砹化氢很稳定
②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸
③砹是黑色固体
④砹化银难溶于水
⑤砹易溶于某些有机溶剂.
①共价化合物含共价键,也可能含离子键
②H2CO3酸性<H2SO3酸性,故非金属性C<S
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的物质是离子化合物
⑥由分子组成的化合物中一定存在共价键
 能使酸性高锰酸钾溶液褪色
B .
能使酸性高锰酸钾溶液褪色
B .  可与溴水发生取代反应使溴水褪色
C .
可与溴水发生取代反应使溴水褪色
C .  在铁作催化剂时能与溴水发生取代反应
D .
在铁作催化剂时能与溴水发生取代反应
D .  在浓硫酸的存在并加热的条件下可与乙酸发生取代反应
在浓硫酸的存在并加热的条件下可与乙酸发生取代反应

|
1 |
① |
|||||||
|
2 |
② |
③ |
④ |
|||||
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
||||
|
4 |
⑨ |
⑩ |
||||||

该反应为反应(填“吸热”或“放热”)。
①加H2O ②加入几滴1mol/LHNO3溶液 ③滴入几滴浓盐酸
④加入一定量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦适当升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
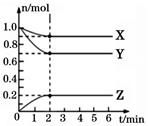
分析有关数据,写出X、Y、Z的反应方程式。

①实验1中,在10~20 min内,以物质Y表示的平均反应速率为mol/(L·min) ,50min时,实验3中Z的浓度。
②0~20min内,其它条件一样实验2 和实验1的反应速率不同,其原因可能是;实验3 和实验1的反应速率不同,其原因是。

①a试管中的主要化学反应的方程式为。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是。
③试管b中液体作用是。

方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案不好;从产品纯度考虑,方案不好。