
该反应为反应(填“吸热”或“放热”)。
①加H2O ②加入几滴1mol/LHNO3溶液 ③滴入几滴浓盐酸
④加入一定量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦适当升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
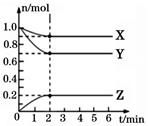
分析有关数据,写出X、Y、Z的反应方程式。

①实验1中,在10~20 min内,以物质Y表示的平均反应速率为mol/(L·min) ,50min时,实验3中Z的浓度。
②0~20min内,其它条件一样实验2 和实验1的反应速率不同,其原因可能是;实验3 和实验1的反应速率不同,其原因是。