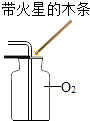
 O2验满
C .
O2验满
C . 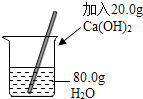 配制20%的Ca(OH)2溶液
D .
配制20%的Ca(OH)2溶液
D . 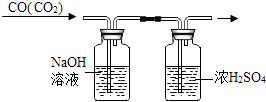 除去CO中的CO2
除去CO中的CO2

①为了得到纯净、干燥的CO2 , 除杂装置(如图)的导管按气流方向连接顺序是(选填字母);
a.1→2→4→3 b.2→1→3→4
c.4→3→1→2 d.3→4→2→1
用化学反应方程式表示饱和NaHCO3溶液的作用.
②写出用澄清石灰水检验CO2的化学反应方程式.

点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象.则该气体为(写化学式).
对白色固体做出如下猜测并进行实验:
【猜测】
查阅资料1:Mg(HCO3)2能溶于水.
①白色固体可能是MgCO3;
②白色固体可能是;
③白色固体可能是MgCO3和Mg(OH)2 .
【实验】
①取洗净后的白色固体,加入足量的溶液,观察到,则白色固体一定含有MgCO3 .
查阅资料2:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
②为进一步确定白色固体的组成,该同学进行了定量实验:
称取干燥的白色固体22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重1.8g,则白色固体中含有,再通过碱石灰,碱石灰增重8.8g,则固体中各成分的质量比为.

a.CH4+2H2O CO2+4H2 b.CH4
C+2H2
c.C+CO2 2CO d.CH4+
+3H2
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
分离所得的CaSO4•2H2O含有CaCO3 , 可用盐酸除去,该的化学反应方程式.

①实验前首先要,再装入样品.装置A的作用是.
②已知CaSO4•2H2O在160℃生成CaSO4 , 1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将(填“偏大”、“偏小”或“无影响”).你认为还可选用上述的(选填序号)两个数据组合也可求出x:y的值.

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为.