
| A.青铜器皿 | B.陶瓷 | C.丝绸 | D.中草药 |
| | | | |

 , 关于该粒子的说法正确的是( )
, 关于该粒子的说法正确的是( )
 B .
B . 
| 选项 | A | B | C | D |
| H2O2溶液的物质的量浓度(mol·L−1) | 1 | 1 | 4 | 4 |
| 反应的温度(℃) | 5 | 40 | 5 | 40 |
| | | | |
| A.除去水中泥沙 | B.收集氨气 | C.分离CCl4和H2O | D.配制100 mL 0.1 mol·L−1 NaCl溶液 |
| 选项 | 实验操作及现象 | 解释或结论 |
| A. | 向某溶液中逐滴加入盐酸,产生无色无味气体 | 此溶液中一定含有CO32- |
| B. | 将干燥和湿润的红色布条,分别放入盛有氯气的集气瓶中,湿润的红色布条褪色 | 氯气与水反应一定产生具有漂白性的物质 |
| C. | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,产生大量白烟 | NH3遇到HCl时反应生成NH4Cl晶体 |
| D. | 向某溶液中逐滴加入NaOH溶液,立即产生白色沉淀,迅速变成灰绿,最终变成红褐色 | 此溶液中一定含有Fe2+ |
|
A |
B |
|
在3种无机物①Cl2、②Na2CO3、 ③NH3中,可用作食用碱的是 (填序号,下同),可用于制漂白液的是, 可用作制冷剂的是。 |
在3种有机物①乙醇、②乙烯、③乙酸中,可用作医用消毒剂的是(填序号,下同),用于除水壶中水垢的是,可作为水果催熟剂的是。 |

|
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑧ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑥ | ⑩ |

a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤

| Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.3 | 6.3 | 4.7 | 2.7 |
| 完全沉淀时 | 9.8 | 8.3 | 6.7 | 3.6 |
a.过程①中有氧化还原反应发生
b.加入MnS的目的是除去溶液中的Cu2+ , 增大Mn2+
c.溶液1中含有的阳离子主要是Fe2+、Fe3+、Cu2+、Mn2+、H+
|
实验 |
操作 |
现象 |
|
I |
常温下将MnO2和12 mol·L-1浓盐酸混合 |
溶液呈浅棕色,略有刺激性气味 |
|
II |
将I中混合物过滤,加热滤液 |
生成大量黄绿色气体 |
|
III |
加热MnO2和4 mol·L-1稀盐酸混合物 |
无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是。
②II中发生了分解反应,反应的化学方程式是。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
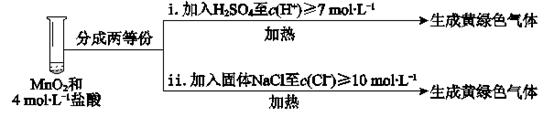
将实验III、IV作对比,得出的结论是;将i、ii作对比,得出的结论是。
|
实验(20oC) |
现象 |
|
Ⅰ.过量铜粉、2 mL 0.5 mol/L HNO3 |
无色气体(遇空气变红棕色),溶液变为蓝色 |
|
Ⅱ.过量铁粉、2 mL 0.5 mol/L HNO3 |
6 mL无色气体(经检测为H2),溶液几乎无色 |
① 甲同学认为该浓度的硝酸中H+的氧化性大于NO3- , 所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法错误,其实验证据是。
② 乙同学通过分析,推测出NO3-也能被还原,依据是,进而他通过实证实该溶液中含有NH4+ , 其实验操作是。