| 金属用途 | 金属的有关性质 | |
| A | 金可以制成比纸还薄的金箔 | 延展性 |
| B | 生活用铁锅 | 导热性 |
| C | 用铁回收照相定影废液中的银 | 氧化性 |
| D | 用铜制作印刷电路 | 导电性 |
 B .
B .  C .
C .  D .
D . 
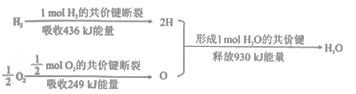

I. H3BO3 +3CH3OH→ B( OCH3)3 +3H2O
II. B(OCH3)3+4NaH→ NaBH4+ 3CH3ONa
①“反应I”的类型为(填标号)。
A.取代反应
B.加成反应
C.加聚反应
D.氧化反应
②NaH的电子式为。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[ B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为。

已知:强酸条件下,2Cu+=Cu+Cu2+
|
pH |
4.00 |
4.50 |
5.40 |
6.20 |
6.50 |
7.00 |
8.00 |
8.50 |
|
废液含铜量/g. L-1 |
19.5 |
2.4 |
2.0 |
0.3 |
0.2 |
2.0 |
8.3 |
17. 0 |

下列说法正确的是
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
![]()
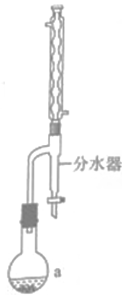
①仪器的名称是,碎瓷片的作用是。
②合成过程最合适的加热方式是。
a.酒精灯直接加热
b.油浴
c.水浴
d.砂浴
③饱和碳酸钠溶液的作用是。
④合成草酸二乙酯的化学方程式为。
⑤草酸二乙酯的产率为(保留小数点后一位)。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21 ℃),NO(-152 ℃)
③酸性KMnO4溶液能氧化NO生成NO3-
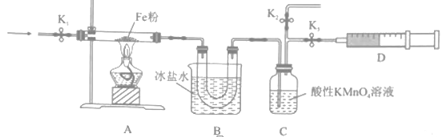
①按上图所示组装完实验仪器后,下一步操作为。
②实验前需利用气体X将装置的空气排净,气体X可以为(填标号)。
A.Ar
B.H2
C.CO
D.NO2
③排净空气后,后续实验的最佳操作顺序是(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2 , 关闭K3 , 缓缓通入气体X d.打开K1和K3 , 关闭K2 , 缓缓通入NO2 e.关闭K1 , 停止通入NO2
④装置B的作用是。
①实验过程中A 、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:。
③实验得到的相关数据如下表:
|
玻璃管质量/g |
Fe 质量/g |
反应后(玻璃管 +固体)/g |
|
m |
1.12 |
m+1.52 |
综合实验现象和计算可知,固体生成物一定有(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为