第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
a.温度 b.Cl﹣的浓度 c.溶液的酸度
Ⅱ含铬元素溶液的分离和利用
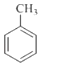 分子中不同化学环境的氢原子共有种,共面原子数目最多为.
分子中不同化学环境的氢原子共有种,共面原子数目最多为.
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
在方框中写出以 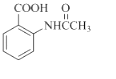 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.
|
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L﹣1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L﹣1 AgNO3溶液(过量),使I﹣完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L﹣1NH4SCN溶液滴定过量的Ag+ , 使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理.
回答下列问题:
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
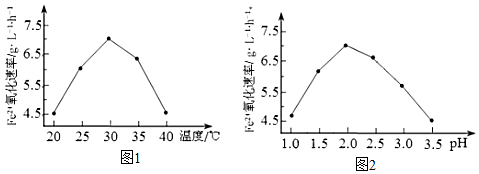
由图1和图2判断使用硫杆菌的最佳条件为.若反应温度过高,反应速率下降,其原因是.
随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为.
方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 Na2SO3溶液
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)
从平衡移动的角度,简述过程②NaOH再生的原理.
已知25℃,NH3•H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的浓度为2.0mol•L﹣1 , 溶液中的c(OH﹣)=mol•L﹣1 . 将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 mol•L﹣1时,溶液中的c(SO32﹣)/c(HSO3﹣)=.