| 选 项 | 归 类 | 内容 |
| A | 可燃性气体 | 氢气、一氧化碳、甲烷 |
| B | 人体中微量元素 | 铜元素、铁元素、碘元素 |
| C | 由分子构成的物质 | 二氧化碳、氧气、氦气 |
| D | 合金 | 青铜、硬铝、生铁 |
 甲:称量
B .
甲:称量
B .  丙:过滤
D .
丙:过滤
D . 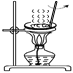 丁:蒸发
丁:蒸发

| 选项 | 物质 | 目的 | 主要实验操作 |
| A | 双氧水 、蒸馏水 | 鉴别 | 取样,加二氧化锰,观察现象 |
| B | CH4中是否含有H2 | 检验 | 点燃,罩一干冷烧杯,观察燃烧产物 |
| C | KCl与MnO2固体混合物 | 分离 | 加水充分溶解后过滤、洗涤、烘干,蒸发 |
| D | FeSO4溶液(CuSO4) | 除杂 | 加过量Fe粉、过滤 |







①合成氨时参加反应的氮气和氢气的质量比为。
②实验中烧杯内导管口有气泡,还可观察到现象。

①生活中常用来区分硬水和软水。
②煮沸硬水可降低水的硬度,同时生成难溶性混合物固体A。
(猜想)固体A中除CaCO3外,还含有:
猜想1:只含MgCO3 猜想2:只含Mg(OH)2 猜想3:MgCO3和Mg(OH)2
(资料)①MgCO3和稀盐酸的反应与CaCO3相似,写出MgCO3和稀盐酸反应的化学方程式。
②Mg(OH)2和稀盐酸反应生成氯化镁和水
(实验)取10.0 g干燥的固体A,加入足量的稀盐酸充分反应,产生4.4 gCO2气体。
(结论)①猜想1、2错误。其中判断猜想1错误的理由是。
②猜想3正确。固体A中MgCO3和Mg(OH)2的质量比是。

铁生锈的主要过程为:
![]()
写出转化②的化学方程式。
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁。

工业上将黄铁矿粉碎的目的是。
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。

资料:碱石灰可吸收H2O和CO2。
连接装置,先,再装入药品。
①固体中Fe质量为g。
②FexOy的化学式为。