 B . 稀释浓硫酸
B . 稀释浓硫酸 C . 检查气密性
C . 检查气密性 D . 测溶液pH
D . 测溶液pH



温度/℃ | 20 | 40 | 50 | 60 | 80 | |
溶解度g | K2CO3 | 110 | 117 | 121 | 126 | 139 |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
选项 | 物质 | 目的 | 主要实验操作 |
A | CaCl2溶液(HCl) | 除杂 | 加入适量的Ca(OH)2溶液 |
B | 稀盐酸和稀硫酸 | 鉴别 | 分别取样,微热,观察瓶口是否有白雾 |
C | NH4NO3(NH4HCO3) | 检验 | 加入氢氧化钠溶液,加热观察是否有气泡 |
D | CaO、CaCO3固体 | 分离 | 溶解、过滤、洗涤、烘干、蒸发 |

选项 | 物质X | 纵坐标Y |
A | 水 | 溶液的质量 |
B | 水 | 溶液的pH |
C | 氢氧化钠溶液 | 溶液的质量 |
D | 氢氧化钠溶液 | 溶液中钙元素的质量 |



①碳酸氢钠俗称。
②下列食品中富含维生素C的是(填序号)。
a.馒头 b.西红柿 c.虾

①利用图1装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强(填“大于”或“小于”)外界大气压;
②利用图2装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是。

利用图3装置进行实验,a点时推入NaOH溶液,b点时推入稀盐酸。
①ab段对应反应的化学方程式;
②bc段压强不变的原因是;
③证明CO2与NaOH溶液发生反应的实验事实是(根据图4曲线变化情况来回答)。
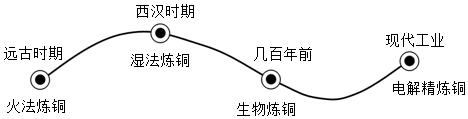
湿法炼铜记载于西汉时期《淮南万毕术》:曾青得铁则化为铜。说明铁的金属活动性比铜(填“强”或“弱”)。
有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对此开展如下探究。
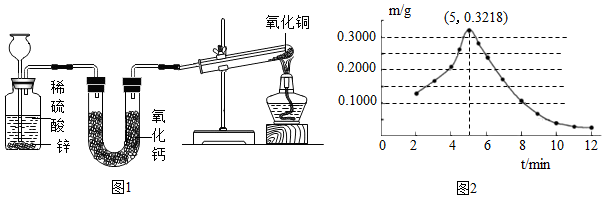
设计如图1所示的实验装置,开展氢气还原氧化铜实验并检验固体产物。
①实验开始时,(填序号)。
A.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
B.先向长颈漏斗中加稀硫酸后点酒精灯
②取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到,证明固体产物Cu2O。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
①为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是。
②在冶金工业中,氢气还原金属氧化物和传统碳还原相比,主要优点在于。
碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,也是人体不可缺少的元素之一,人体内缺少碘会引起甲状腺肿大,幼儿缺碘还会影响生长发育。因此,我国在1979年提出,在食盐中加入碘,以满足人体对碘的需求。
自然界中,大部分土壤、岩石、江河湖水中的碘含量都很低,而海水中却蕴藏丰富,同时很多海藻和贝类等动植物体内都含有丰富的碘,主要是因为某些海藻具有吸附碘的能力,如干海带中碘的含量一般为0.3%~0.5%,比海水中碘的浓度高10万倍。在实验室里可以用简单的方法检验海带中含有碘元素:将干海带剪碎放入烧杯中加水浸泡,取少量海带浸泡液于另一烧杯中,再加入少量淀粉,此时得到白色悬浊液。用滴管取过氧化氢溶液逐滴滴加并振荡,可看到悬浊液变蓝,说明有碘单质(I2)生成。反应原理是浸泡海带时,得到含有碘化钠(NaI)的溶液,H2O2与碘化钠反应生成碘单质和一种常见的碱,碘单质遇淀粉溶液变蓝。工业上,可用氯气(Cl2)从含有碘化钠的海产品中提取碘单质,同时生成氯化钠。
航天员王亚平借助化学反应让奥运五环在中国空间站上飘浮。首先在透明的五环模型中加入了无色的透明溶液依次是1、4、5号环中的碳酸钠、2号环中的碘化钾、碘酸钾,3号环中的乙酸溶液,看似完全相同的透明五环在加入不同试剂后就显现出了不同颜色。
依据文章内容和所学知识,回答下列问题:
方案一:将盐酸滴入NaOH溶液的过程中,用pH传感器探究反应过程。当pH≤7即可确定二者发生了化学反应。实验测得其图像如图所示。

b点表示溶液中的溶质是。
【提出问题】
氢氧化钠溶液和盐酸混合时,溶液温度升高是否能得出该反应放热的结论?为此,需补做下列两个实验。
①向10mL5%的氢氧化钠溶液中逐滴加入,边加边搅拌,并用温度传感器测定实验过程中温度的变化。
②将实验①中的氢氧化钠溶液替换为同浓度的盐酸,并再次进行实验。实验所得图像分别如图1、图2:


由图可知,盐酸、氢氧化钠溶液稀释时均(填“放热”或“吸热”),但它们稀释时温度的变化量远(填“大于”或“小于”)两溶液混合时温度的变化量。
【实验结论】氢氧化钠溶液和盐酸的反应是放热反应。

【查阅资料】
①电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
②相同温度下同种溶液电导率越大离子浓度越大。
【分析与讨论】
①AB段曲线下降的原因是。
②如图表示该反应过程中烧杯中不同时间点的微观粒子示意图,按时间先后排列的顺序为(填字母)。


课外活动小组用如图所示装置将稀盐酸滴入20mL溶质质量分数为5%的NaOH溶液中,溶液的温度和pH随稀盐酸体积(V)的变化曲线如下图所示。


通过该实验给出的判断,其中正确的是。
a.进行该实验时环境温度约为22-23℃
b.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
c.该实验表明化学能可转化为热能