 B .
B .  C .
C .  D .
D . 
| W | ||||
| X | Y | Z |
| 实验操作 | 实验现象 | |
| A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
| B | 将镁条点燃后迅速伸入集满 | 集气瓶中产生浓烟并有黑色颗粒产生 |
| C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
| D | 向盛有 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
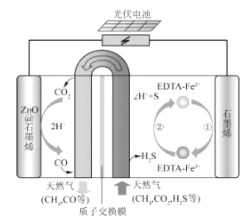
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时,下列叙述错误的是( )

可知反应平衡常数
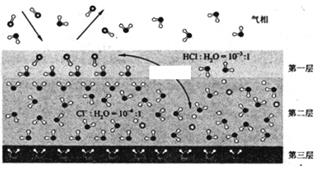
(填“大于”或“小于”。设HCl初始浓度为
,根据进料浓度比
:
:1的数据计算
列出计算式。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比
:
过低、过高的不利影响分别是。
则 的
。
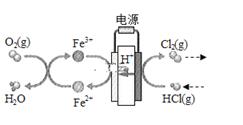
负极区发生的反应有写反应方程式。电路中转移1mol电子,需消耗氧气L(标准状况。
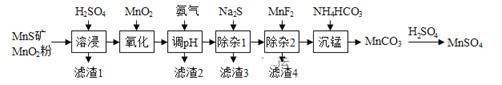
相关金属离子 形成氢氧化物沉淀的pH范围如下:
| 金属离子 | | | | | | | |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
②在同一温度下用CO还原 ,平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原 为
的倾向是CO
(填“大于”或“小于”。
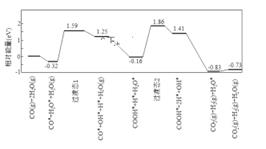
可知水煤气变换的 0(填 “大于”“等于”或“小于”,该历程中最大能垒活化能)
eV,写出该步骤的化学方程式。
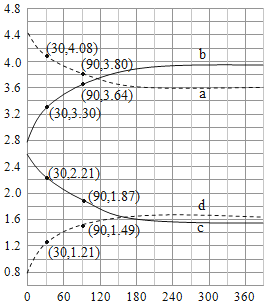
计算曲线a的反应在30~90min内的平均速率 =
时
和
随时间变化关系的曲线分别是、。
时
和
随时间变化关系的曲线分别是、。