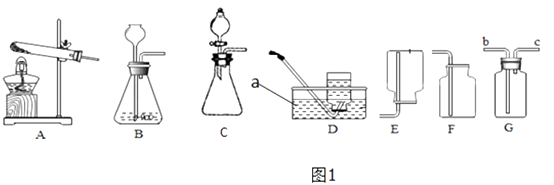
 点燃酒精灯
B .
点燃酒精灯
B .  加热液体
D .
加热液体
D . 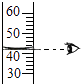 读取液体体积
读取液体体积
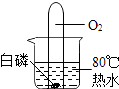 B . 小气球变瘪
B . 小气球变瘪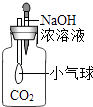 C . U型管内液面左高右低
C . U型管内液面左高右低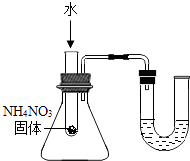 D . 验证Fe、Cu、Ag的金属活动性强弱
D . 验证Fe、Cu、Ag的金属活动性强弱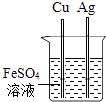
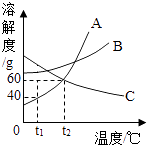
选项 | 物质 | 杂质 | 除杂药品或方法 |
A | CaCl2 | 盐 酸 | 过量的碳酸钙、过滤 |
B | CaO | CaCO3 | 适量的稀盐酸 |
C | N2 | O2 | 灼热的铜网 |
D | CO | CO2 | 足量的氢氧化钠溶液、浓硫酸 |
A、对现象的认识 | B、对安全的认识 |
①镁在空气中燃烧生成白色固体 ②紫色石蕊溶液能使稀盐酸变红 ③羊毛灼烧后有烧焦羽毛气味 | ①霉变的大米必须洗净后方可食用 ②可燃性气体点燃前必须验纯 ③家中天然气泄漏立即关闭阀门轻轻开窗 |
C、对原理等的认识 | D、对科学家贡献的认识 |
①用洗涤剂清洗油污是利用溶解的原理 ②闻到花香是因为分子在不停地运动 ③用排水法收集氧气,是因为氧气难溶于水 | ①拉瓦锡﹣﹣测定空气的组成 ②门捷列夫﹣﹣元素周期律的发现 ③道尔顿﹣﹣原子论的创立 |
①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2 , 生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失.
综合上述实验现象,下列判断正确的是( )
①常用来改良酸性土壤的碱②汽水中的酸
③人体中含量最多的元素④硝酸铵中的阳离子

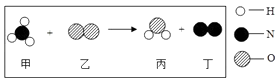
①验证反应甲:小明将无色酚酞溶液滴入NaOH溶液中,溶液呈色.
②小明用示意图2来说明反应丙的发生,写出该反应的化学方程式:.
③请你写出一个化学反应方程式,满足反应丁能够发生,该反应的基本类型是.
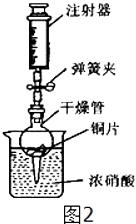
①检查装置的气密性:关闭弹簧夹,将干燥管放入带有水的烧杯中,若观察到,则表明该装置的气密性良好.
②打开弹簧夹,用注射器慢慢抽取干燥管内的气体,浓硝酸沿着干燥管慢慢上升,直到硝酸与铜片接触,停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象是:.
③上述实验完成后,须用足量NaOH溶液将气体吸收,其目的是.
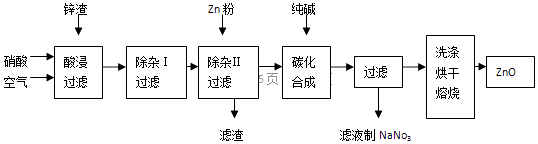
信息:1、3FeO+10HNO3═3Fe(NO3)3+NO+5H2O,NO有毒,能与氧气和水反应生成硝酸.2、在“除杂Ⅰ”步骤中,只有铁离子能形成氢氧化铁沉淀.
回答下列问题
(一)制备探究:如图是工业生产纯碱的主要流程示意图.
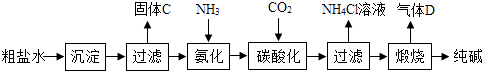
[查阅资料]
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
[提出问题]纯碱样品中含有哪些杂质?
[猜想]
猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:NaHCO3和NaCl
[实验探究]确定纯碱中是否含NaHCO3 . 实验装置和主要实验步骤如下:
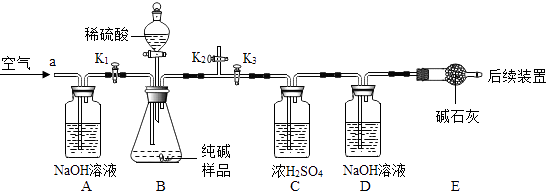
①称量D、E装置总质量为200.0g,检查装置的气密性,将10.6 g纯碱试样放入锥形瓶中,按上图组装仪器,进行如下操作…………,后缓缓鼓入一段时间空气;
②按一定要求正确操作后,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1 , 从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
[实验讨论]
步骤①中“如下操作”是指;