 C . 次氯酸的结构式:H-Cl-O
D . 氯离子的结构示意图:
C . 次氯酸的结构式:H-Cl-O
D . 氯离子的结构示意图: ![]()

|
容器 |
容积 |
起始物质的量/mol |
|
||
|
N2O |
N2 |
O2 |
|||
|
Ⅰ |
V1 |
0.1 |
0 |
0 |
|
|
Ⅱ |
V2 |
0.1 |
0 |
0 |
|
|
Ⅲ |
V3 |
0.1 |
0 |
0 |
|
下列说法不正确的是( )
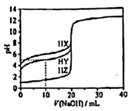

下列说法正确的是( )

已知:①“滤渣1”的主要成分为SiO2、Fe2O3、Al2O3;
②H3BO3+H2O H++B(OH)4- , Ka=5.81×10-10
下列说法不正确的是( )
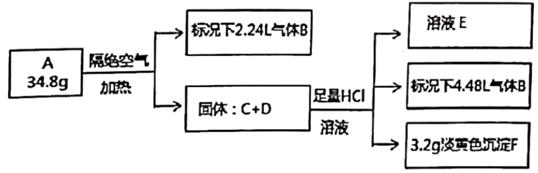
请回答:
2N2O5(g) 4NO2(g)+O2(g);△H>0
①该反应自发进行的条件是。
②下表为反应在T1温度下的部分实验数据
|
t/s |
0 |
500 |
1000 |
|
C(N2O5)mol·L-1 |
5.00 |
3.52 |
2.48 |
在500s时,υ正 υ逆(填“>”、“<”或“=”)。
若在T2温度下进行实验,1000s时测得反应体系中NO2浓度为4.98mol·L-1 , 则T2T1(填“>”、” <“或“=”)

①337.5K时,反应平衡常数K= 。
②已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJ·mol-1
2NO(g)+O2(g =2NO2(g) △H=-113.0kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H= kJ.mol-1

已知:无水硝酸可在液态N2O4中发生微弱电离。写出生成N2O5的电极反应式 。

相关物质在水中的溶解度如下表所示:
| 溶解度/g | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 20 | 36.0 | 21.7 | 37.2 | 9.60 |
| 30 | 36.3 | 28.4 | 41.4 | 11.1 |
| 40 | 36.6 | 36.6 | 45.8 | 12.7 |
请回答:
【方案甲】实验流程如下:
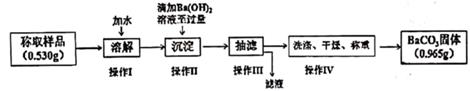
①称取样品质量时,先将称量纸放在电子天平秤盘的中央,显示数字稳定后按“去皮”键,再缓缓加样品至显示出所需样品的质量时,停止加样,,直接记录称取样品的质量。(请补充完整操作)

②操作Ⅲ,抽滤时,用玻璃纤维替代滤纸的理由是。
【方案乙】实验装置如下:

涉及的实验步骤如下:
a.按图组装仪器,并检查装置的气密性;
b.将m1g试样放入锥形瓶中,加适量蒸馏水溶解,到试样溶液;
c.称量盛有碱石灰的U型管的质量,得到m2g
d.从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止;
e.从导管A处缓缓鼓人一定量的空气;
f.打开活塞B,关闭活塞C;
g关闭活塞B,打开活塞C;
h.再次称量盛有碱石灰的U型管的质量,得到m3g;
③请选择合适的编号,按正确的操作顺序补充完整a→b→c→f→ →h(操作可重复使用)。
①分子中有一个含氮六元环;
②核磁共振氢谱显示分子中有5种氢原子,红外光谱显示分子中有甲基。