①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是( )
 B .
B .  C .
C .  D .
D . 
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1 HNO2溶液的pH=2.1
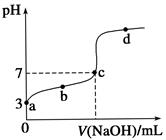
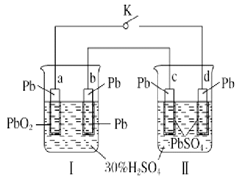
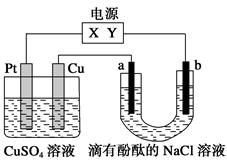
A.物质
A.向正反应方向移动
B.向逆反应方向移动
C.不移动

①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时;t8时。
②t2时平衡向(填“正反应”或“逆反应”)方向移动。